题目内容
【题目】如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
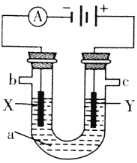
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①电解池中在X极附近观察到的现象是________。
②检验Y电极上电极反应产物的方法是________。
(2)若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①Y电极的材料是_______,电极反应式是_____。(说明:杂质发生的电极反应不必写出)
②当电路中有0.04mol电子通过时,阴极增重________g。
【答案】有气泡产生,溶液变红色将湿润的KI-淀粉试纸置于c口处,试纸变蓝粗铜Cu-2e-=Cu2+1.28
【解析】
(1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,氯气能使湿润的碘化钾淀粉试纸变蓝;
(2)电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜做阳极,精铜做阴极;依据电子守恒计算析出铜的质量。
(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,即电解池中在X极附近观察到的现象是有气泡产生,溶液变红色;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl――2e-=Cl2↑,氯气能使湿润的碘化钾淀粉试纸变蓝,可以用于氯气的检验,即将湿润的KI-淀粉试纸置于c口处,试纸变蓝,说明生成的气体是氯气;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,阳极是粗铜,则Y电极的材料是粗铜,电极反应为Cu-2e-=Cu2+;
②假若电路中有0.04mol电子通过时,阴极电极反应Cu2++2e-=Cu,则阴极增重铜0.02mol,质量为0.02mol×64g/mol=1.28g。

 阅读快车系列答案
阅读快车系列答案【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
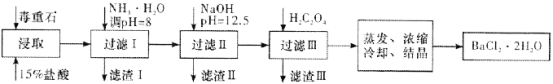
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___(填字母)。
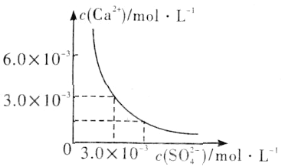
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大