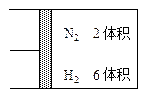题目内容
(8分)在某温度下,将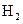 和
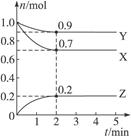
和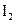 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定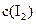 的变化,5S时测定
的变化,5S时测定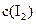 =0.0080mol/L并保护不变。
=0.0080mol/L并保护不变。
(1)反应在达到平衡过程中,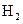 的平均消耗速率为 mol/L·S;
的平均消耗速率为 mol/L·S;
(2)反应的平衡常数的表达式是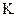 = ;
= ;
(3)此温度下,平衡常数值为 ;
(4)若在此温度下,在10L的密闭器充入0.2molHI气体,达到平衡时,HI的转化率为 。
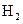 和
和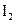 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定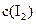 的变化,5S时测定
的变化,5S时测定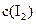 =0.0080mol/L并保护不变。
=0.0080mol/L并保护不变。(1)反应在达到平衡过程中,
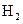 的平均消耗速率为 mol/L·S;
的平均消耗速率为 mol/L·S;(2)反应的平衡常数的表达式是
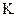 = ;
= ;(3)此温度下,平衡常数值为 ;
(4)若在此温度下,在10L的密闭器充入0.2molHI气体,达到平衡时,HI的转化率为 。
(1) 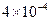 (2)
(2)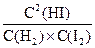
(3) 0.25 (4) 80%
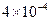 (2)
(2)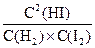
(3) 0.25 (4) 80%
解:(1)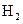 和
和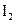 的反应方程式为:
的反应方程式为:
由速率公式: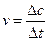
 得
得

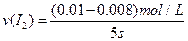
=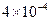
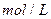
∵化学反应速率之比与方程式中的系数比是一个正比关系
∴
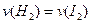 =
=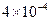
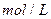
(2)平衡常数就是在一定温度下,当一个可逆反应达到平衡状态时,生成物浓度的方次乘积与反应物浓度的方次乘积的比值,用K表示。所以 的K的表达式为
的K的表达式为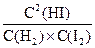 。
。
(3)解:设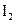 浓度的变化为xmol/L.
浓度的变化为xmol/L. 


始(mol/L) 0.01 0.01
变 x x 2x
平 0.01-x 0.0080 2x
依题可列等式: 0.01-x=0.0080
X=0.002(mol/L)
K=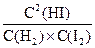 =
=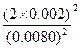 =0.25
=0.25
(4) 是一个体积不变的可逆反应,在恒温恒容条件下,充入0.2molHI与题给条件下的平衡建立一个等同的等效平衡。设HI变化2
是一个体积不变的可逆反应,在恒温恒容条件下,充入0.2molHI与题给条件下的平衡建立一个等同的等效平衡。设HI变化2 ymol.
ymol.

始(mol) 0 0 0.2
变 y y 2y
平 0.080 0.080 0.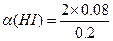 2-2y
2-2y
依题可列等式: y=0.0080(mol/L)
∴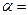
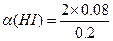 =80%
=80%
 和
和 的反应方程式为:
的反应方程式为:
由速率公式:
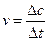
 得
得
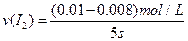
=
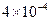
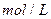
∵化学反应速率之比与方程式中的系数比是一个正比关系

∴

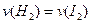 =
=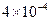
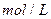
(2)平衡常数就是在一定温度下,当一个可逆反应达到平衡状态时,生成物浓度的方次乘积与反应物浓度的方次乘积的比值,用K表示。所以
 的K的表达式为
的K的表达式为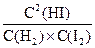 。
。(3)解:设
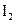 浓度的变化为xmol/L.
浓度的变化为xmol/L. 


始(mol/L) 0.01 0.01
变 x x 2x
平 0.01-x 0.0080 2x
依题可列等式: 0.01-x=0.0080
X=0.002(mol/L)
K=
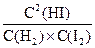 =
=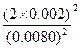 =0.25
=0.25(4)
 是一个体积不变的可逆反应,在恒温恒容条件下,充入0.2molHI与题给条件下的平衡建立一个等同的等效平衡。设HI变化2
是一个体积不变的可逆反应,在恒温恒容条件下,充入0.2molHI与题给条件下的平衡建立一个等同的等效平衡。设HI变化2 ymol.
ymol.
始(mol) 0 0 0.2
变 y y 2y
平 0.080 0.080 0.
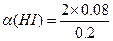 2-2y
2-2y 依题可列等式: y=0.0080(mol/L)
∴
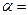
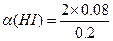 =80%
=80%
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 的总量,可采取的措施是( )
的总量,可采取的措施是( ) 固体
固体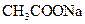 固体
固体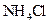 固体
固体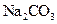 固体
固体 2SO3,当此反应进行到一定程度时,反应混合物处于化学平衡状态。若维持容器温度不变,令a,b,c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如a,b,c取不同的值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。请填写下列空白:
2SO3,当此反应进行到一定程度时,反应混合物处于化学平衡状态。若维持容器温度不变,令a,b,c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如a,b,c取不同的值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。请填写下列空白:

 (正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:
(正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题: