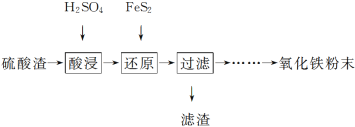
题目内容
【题目】实验室用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备碱式碳酸铜的主要实验流程如下。

(1)滤渣Ⅰ的成分为MnO2、单质S和 (写化学式);硫酸浸取时,Cu2S被MnO2氧化的化学方程式为 。
(2)浸取时,Fe2O3溶于硫酸的离子方程式为 ;研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是 。
(3)“赶氨”时,最适宜的操作方法是 。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
【答案】(1)SiO2;2MnO2 + Cu2S + 4H2SO4 = 2MnSO4 + 2CuSO4 +S+4H2O
(2)Fe2O3+6H+=2Fe3++3H2O;Fe3+可催化Cu2S被MnO2氧化(或答:Fe2O3在浸取时起媒介作用)
(3)将溶液加热(4)(NH4)2SO4
【解析】
试题分析:(1)辉铜矿中含有Cu2S、Fe2O3、SiO2,加入 H2SO4 和 MnO2 后,Cu2S 中+1 的 Cu 和-2 价的 S 均被氧化生成 Cu2+和 S,Fe2O3 溶解生成 Fe3+,SiO2 不溶于 H2SO4,故滤渣中还含有 SiO2。Cu2S 在 H2SO4 作用下,被 MnO2 氧化, 产物有 S、CuSO4、MnSO4 和 H2O,根据化合价升降总值相等得,其反应的化学方程式2MnO2 + Cu2S + 4H2SO4 = 2MnSO4 + 2CuSO4 +S+4H2O。 (2)Fe2O3 为难溶的氧化物,浸取时,Fe2O3溶于硫酸的离子方程式为Fe2O3+6H+=2Fe3++3H2O;由题意分析知,除铁后速率 变慢,说明 Fe3+对浸取速率是有影响的,可联想到 Fe3+可能作催化剂。(3)此处考查 NH3 具有挥发性的性质,以及[Cu(NH3)4]2+受热分解为 Cu2+ 和 NH3,故采用加热的方法可将 NH3 从溶液中赶出。(4)分析流程图,第一步中加入了 H2SO4,在整个过程中,没有除SO42- ,阳离子Fe3+、Mn 均以沉 淀形式除去,Cu2+进入主产物碱式碳酸铜中,所以滤液中应含有 NH4+ ,故蒸发得到的盐为(NH4)2SO4。