题目内容
【题目】众所周知H2S、SO2、NO和CO都是常见的大气污染物。
(1)下列关于H2S和SO2的说法正确的是______
A.两气体都可用浓硫酸干燥
B.两气体均可以用NaOH溶液吸收
C.可用溴水或酸性KMnO4溶液鉴别两气体
(2)目前治理汽车尾气是在催化剂条件下发生反应2NO+2CO![]() N2+2CO2,现在实验室模拟上述反应,已知t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
N2+2CO2,现在实验室模拟上述反应,已知t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
①这段时间内用CO表示的化学反应速率为_________________ 。
②该反应平衡常数为______________(保留两位有效数字)。
③平衡后再向密闭容器通入0.4molCO和0.4molCO2,平衡将_____________(填“正向”、“逆向”或“不”)移动。判断理由是_____________。
④若升温发现体系气体平均相对分子质量增大,则该反应的△H______0(填“>”、“<”或“=”)。
⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,则与原平衡相比NO的转化率____________ (填“增大”、“减小”或“不变”)。
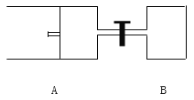
(3)如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,起始时VA=VB=aL。在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y![]() 2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:
2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:
①A中X的转化率αA=______________
②A、B中X的转化率αA______αB(填“>、=、<”)。
③打开阀门,一段时间后又达到平衡时,A的体积为___ L(连通管中的气体体积不计)
【答案】B 0.02mol·L-1·min-1 0.069 逆向 通入气体后Qc大于平衡常数 > 增大 40% > 2.6a
【解析】
(1).A.H2S可以被浓硫酸氧化,不能用浓硫酸干燥,SO2与浓硫酸不反应,可以用浓硫酸干燥,故A错误;
B.两气体都能和NaOH溶液反应,被NaOH溶液吸收,故B正确;
C.两气体都能被溴水或酸性KMnO4溶液氧化,不能用溴水或酸性KMnO4溶液鉴别,故C错误,答案为:B;
(2). ①. 设10min达到平衡时NO消耗2x mol,根据平衡三段式法有:
2NO+2CO![]() N2+2CO2
N2+2CO2
起始量(mol) 2 1 0 0
转化量(mol) 2x 2x x 2x
平衡量(mol) 2-2x 1-2x x 2x,平衡时气体总物质的量为(2-2x)+(1-2x)+x+2x=(3-x)mol,则![]() =
=![]() ,解得x=0.2mol,则这段时间内用CO表示的化学反应速率为v(CO)=
,解得x=0.2mol,则这段时间内用CO表示的化学反应速率为v(CO)=![]() =
=![]() =0.02 mol·L-1·min-1,故答案为:0.02 mol·L-1·min-1;
=0.02 mol·L-1·min-1,故答案为:0.02 mol·L-1·min-1;
②. 该反应平衡常数K=![]() =
=![]() =0.069,故答案为:0.069;
=0.069,故答案为:0.069;
③.平衡后再向密闭容器通入0.4molCO和0.4molCO2,Qc=![]() =0.1>K=0.069,平衡逆向移动,故答案为:逆向;通入气体后Qc大于平衡常数;
=0.1>K=0.069,平衡逆向移动,故答案为:逆向;通入气体后Qc大于平衡常数;
④. 2NO+2CO![]() N2+2CO2的正反应为气体体积减小的可逆反应,升温发现体系气体平均相对分子质量增大,说明升高温度平衡正向移动,升高温度平衡向吸热反应方向移动,则该反应的正反应为吸热反应,△H>0,故答案为:>;
N2+2CO2的正反应为气体体积减小的可逆反应,升温发现体系气体平均相对分子质量增大,说明升高温度平衡正向移动,升高温度平衡向吸热反应方向移动,则该反应的正反应为吸热反应,△H>0,故答案为:>;
⑤. 维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,相当于增大压强,增大压强平衡正向移动,NO的转化率增大,故答案为:增大;
(3). ①. A为恒压容器,等温等压的条件下,气体的体积之比等于气体的物质的量之比,2mol气体时体积为aL,达到平衡时VA=1.2aL,所以平衡后混合气体的物质的量为2.4mol,设X物质反应了n mol,则:
X + Y![]() 2Z + W △n
2Z + W △n
1mol 1mol
n mol (2.42)mol
解得n=0.4mol,所以X的转化率=![]() ×100%=40%,故答案为:40%;
×100%=40%,故答案为:40%;
②. B装置是在等容条件下,反应向正反应方向移动时,混合气体的物质的量增大,导致容器内气体压强增大,增大压强平衡逆向移动,X的转化率减小,所以B容器中X的转化率比A小,故答案为:>;
③.当打开阀门时,整个装置是在等温、等压条件下反应,使整个装置中气体的压强与A装置中的初始压强相同,向A中充入1molX和1molY达到平衡时,VA=1.2aL,当打开阀门时,AB中气体为3molX和3molY,由于整个装置是在等温、等压条件下的反应,达到平衡状态时,混合气体的体积应是3.6aL,其中B是aL,所以A为2.6aL,故答案为:2.6a。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案