题目内容
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
| A.在自然界中只以化合态的形式存在 | B.单质常用作半导体材料和光导纤维 |
| C.最高价氧化物不与任何酸反应 | D.气态氢化物比甲烷稳定 |
A
解析试题分析:某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素为硅。A、Si在自然界中没有单质,故A正确;B、制造光导纤维的材料是二氧化硅,故B错误;C、二氧化硅可以与氢氟酸反应,故C错误;D、C的非金属性大于Si的,甲烷比硅化氢稳定,故D错误.故选A.
考点:本题考查了元素的推断和元素的性质,熟悉核外电子排布是解决本题的关键.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是
①KMnO4(H+,aq) ②溴水 ③碘水 ④氯水 ⑤Fe3+(aq)
| A.①⑤ | B.②③④ | C.全部 | D.都不是 |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )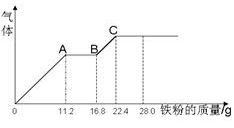
| A.原混合液中NO3-的物质的量为0.4mol |
| B.c(H2SO4)为5mol·L-1 |
| C.溶液中最终溶质为FeSO4 |
| D.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气 |
硫酸铵在强热条件下分解:4(NH4)2SO4=6NH3↑+N2↑+3SO2↑+SO3↑+7H2O若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
| A.BaSO3和BaSO4 | B.BaS | C.BaSO3 | D.BaSO4 |
下列说法中,正确的是
| A.水晶和陶瓷的主要成分都属于硅酸盐 | B.单质硅是制造光导纤维的材料 |
| C.硅酸钠是制备硅胶和木材防火剂的原料 | D.工业上用盐酸刻蚀玻璃 |
下列现象不能用于检验NH3的是
| A.气体遇浓盐酸产生白烟 |
| B.气体使湿润的蓝色石蕊试纸变红 |
| C.气体通人酚酞溶液中,溶液变红 |
| D.气体使湿润的红色石蕊试纸变蓝 |
下列实验现象的描述错误的是
| A.氢气在氯气中燃烧产生苍白色火焰 |
| B.红热的铁丝在氯气中燃烧,火星四射,生成黑色固体颗粒 |
| C.红热的铜丝在氯气中燃烧,产生棕黄色烟 |
| D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
将相同质量的两铜片分别和浓硝酸、稀硝酸(两者均过量)反应,下列叙述正确的是( )
| A.出现钝化现象:浓硝酸会,稀硝酸不会 |
| B.消耗HNO3的物质的量:前者多,后者少 |
| C.反应生成气体的颜色:前者浅,后者深 |
| D.反应中转移的电子总数:前者多,后者少 |
下列反应有氢气放出的是( )
| A.Fe+H2SO4(浓) | B.Fe+HNO3(稀) |
| C.Fe+H2SO4(稀) | D.Cu+H2SO4(稀) |