题目内容
5.VL Fe(SO4)3溶液中含有ag SO42-,则SO42-,的物质的量浓度为$\frac{a}{96V}$mol/L;取此溶液0.5VL,其中Fe3+的物质的量浓度为$\frac{a}{144V}$mol/L,用水稀释至2VL,稀释后溶液中Fe3+的物质的量浓度为$\frac{a}{576V}$mol/L.分析 根据n=$\frac{m}{M}$计算a克SO42-的物质的量,然后根据物质的量浓度c(SO42-)=$\frac{n}{V}$来计算;由于Fe2(SO4)3中Fe3+和SO42-之比为2:3,故c(Fe3+)=$\frac{2}{3}$c(SO42-),与所取溶液的体积无关;溶液由0.5VL稀释至2VL,溶液体积增大4倍,则浓度变为原来的$\frac{1}{4}$,据此计算.
解答 解:a克SO42-的物质的量n=$\frac{ag}{96g/mol}$=$\frac{a}{96}$mol,故SO42-的物质的量浓度c(SO42-)=$\frac{n}{V}$=$\frac{\frac{a}{96}mol}{VL}$=$\frac{a}{96V}$mol/L;由于Fe2(SO4)3中Fe3+和SO42-之比为2:3,故溶液中Fe3+的物质的量浓度c(Fe3+)=$\frac{2}{3}$c(SO42-)=$\frac{a}{144V}$mol/L,与所取溶液的体积无关;当溶液由0.5VL稀释至2VL,溶液体积增大4倍,则浓度变为原来的$\frac{1}{4}$,故稀释后c(Fe3+)=$\frac{a}{144V}$mol/L×$\frac{1}{4}$=$\frac{a}{576V}$mol/L.
故答案为:$\frac{a}{96V}$mol/L;$\frac{a}{144V}$mol/L;$\frac{a}{576V}$mol/L.
点评 本题考查了溶液中离子浓度的计算,应注意离子的浓度大小和所取溶液的体积无关,难度不大,注意公式的灵活运用.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
15.下列各组物质中互为同系物的是 ( )
| A. | 甲醇、乙二醇 | B. | 丙三醇、乙二醇 | C. | 甲醚、乙醇 | D. | 甲醇、2-丙醇 |
16.下列说法正确的是( )
| A. | 利用海水不经化学变化即可制得食盐和淡水 | |
| B. | 在新装修的居室里放置数盆清水,可有效地吸收房间中释放的甲醛、苯等有害气体 | |
| C. | 等质量的乙烯和聚乙烯燃烧时,聚乙烯产生的二氧化碳多 | |
| D. | 石油分馏可获得乙酸、苯等 |
20.下列物质中,所含分子个数最多的是( )
| A. | 0.05mol H3PO4 | B. | 1.204×1024个CH4 | C. | 2.0 mol HCl | D. | 3.5mol N2 |
10.25℃、101kPa下,二氧化碳和过氧化钠反应后,若固体质量增加了14g,反应中有关物质的物理量正确的是( )
| O2 | Na2CO3 | CO2 | 转移电子数 | |
| A | 1mol | 0.5NA | ||
| B | 0.5mol | 11.2L | ||
| C | 0.25mol | 53g | ||
| D | 8g | NA |
| A. | A | B. | B | C. | C | D. | D |
2.铵明矾NH4Al(SO4)2•12H2O是分析化学常用基准试剂,其制备过程如下.下列分析不正确的是( )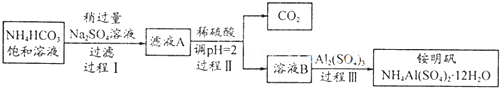

| A. | 过程I反应:2NH4HCO3+Na2SO4═2NaHCO3↓+(NH4)2SO4 | |
| B. | 检验溶液B中阴离子的试剂仅需BaCl2溶液 | |
| C. | 若省略过程II则铵明矾产率明显减小 | |
| D. | 向铵明矾溶液中逐滴加入NaOH溶液先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失 |
3.合成氨是人类科学技术上的一项重大突破.工业上以天然气为原料合成氨.其生产工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
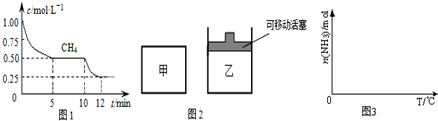
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如图1所示.反应中处于平衡状态的时间为5min-10min、12min后;10min时,改变的外界条件可能是升高温度.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4);
(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g),一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应中正、逆反应速率的关系式是a(填序号).
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol?1
①依据温度对合成氨反应的影响,在如图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如图1所示.反应中处于平衡状态的时间为5min-10min、12min后;10min时,改变的外界条件可能是升高温度.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4);

(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g),一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol?1
①依据温度对合成氨反应的影响,在如图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.