题目内容
2.实验室制取氯气的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.,其中氧化剂是MnO2,还原剂是HCl,氧化产物是Cl2,还原产物是MnCl2,用排饱和食盐水法收集,剩余的氯气用氢氧化钠溶液吸收.工业上制取氯气的反应式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;氯气常用于杀菌、消毒、漂白.分析 实验室制取氯气的反应物是二氧化锰和浓盐酸,产物是氯化锰和氯气、水,条件是加热,反应中化合价降低元素所在的反应物是氧化剂,该元素被还原,化合价升高元素所在的反应物是还原剂,该元素被氧化;收集氯气可以用排饱和食盐水,氯气能被碱液吸收;工业上用电解饱和食盐水法制取氯气,电解饱和食盐水生成氯气、氢气和氢氧化钠;根据氯气的性质判断其用途.
解答 解:实验室制取氯气的反应物是二氧化锰和浓盐酸,产物是氯化锰和氯气、水,条件是加热,反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O;
反应中,化合价降低元素是Mn元素,所在的反应物MnO2是氧化剂,还原产物为MnCl2;化合价升高元素是Cl元素,所在的反应物HCl是还原剂,被氧化生成氧化产物为Cl2;氯气在饱和食盐水中溶解度很小,则收集氯气可以用排饱和食盐水,氯气能被碱液吸收,所以剩余的氯气用氢氧化钠溶液吸收;电解饱和食盐水生成氯气、氢气和氢氧化钠,化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;氯气溶于水生成HClO,能用于杀菌、消毒、漂白等.
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O;MnO2;HCl;Cl2;MnCl2;排饱和食盐水;氢氧化钠溶液;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;杀菌;消毒;漂白.
点评 本题考查了氧化还原反应、化学方程式的书写等,明确氧化还原反应原理以及有关反应实质是解题关键,题目难度不大.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案| A. | NaHCO3=Na++HCO3- | B. | H2SO4=2H++SO42- | ||
| C. | Na2S=Na22++S2- | D. | NaHSO4=Na++H++SO42- |
| A. | Mg2+ | B. | Cl- | C. | Ag+ | D. | NO3- |
| A. | 明矾水解时,产生具有吸附性的胶体粒子,可做净水剂 | |
| B. | 用氢氧化铝、碳酸氢钠或烧碱治疗胃酸过多 | |
| C. | 二氧化硫是无色气体,有强烈刺激性气味,是大气主要污染物之一,可以用作食物和干果的防腐剂 | |
| D. | 氯气制备消毒液或漂白粉 |
| A. | NH4+ K+ Na+ CO32- NO3- | B. | K+ Na+ Fe2+ SO42- NO3- | ||
| C. | NH4+ K+ Na+ HCO3-[Al(OH)4]- | D. | NH4+ K+ Na+ NO3- I- |
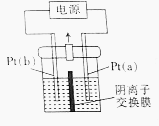 如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.
如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.