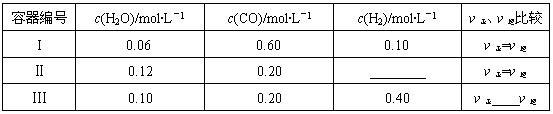
题目内容
(8分,每空格2分)常温下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列顺序为 (填序号);
(2)实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是浑浊的溶液,产生浑浊的原因是(用离子方程式表示)
(3)物质的量浓度相同的①氨水②氯化铵③碳酸氢铵④硫酸氢铵⑤硫酸铵
在上述五种溶液中,铵根离子物质的量浓度由大到小的顺序是
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(1)①②⑤⑥③④ (2)Fe3++3H2O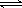 Fe(OH)3+3H+
Fe(OH)3+3H+
(3)⑤>④>②>③>①
(4)N2(g)+3H2(g)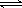 2NH3(g);△H=-92.0kJ/mol (3分)
2NH3(g);△H=-92.0kJ/mol (3分)
【解析】(1)盐酸是强酸,醋酸是弱酸,醋酸钠水解显碱性,氢氧化钠是强碱,氯化铁水解显酸性,氯化钠不水解显中性,所以pH由小到大排列顺序为①②⑤⑥③④。
(2)氯化铁水解生成氢氧化铁,因而会产生混浊,方程式为Fe3++3H2O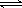 Fe(OH)3+3H+。
Fe(OH)3+3H+。
(3)氨水是弱碱,铵根离子浓度最小。磷酸氢铵电离出的氢离子能一种NH4+的水解,碳酸氢铵中的HCO3-水解显碱性,促进NH4+的水解,铵根离子物质的量浓度由大到小的顺序是⑤>④>②>③>①。
(4)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此生成2mol氨气的反应热是436kJ/mol×3+946kJ/mol-391kJ/mol×3×2=-92.0kJ/mol,所以热化学方程式为N2(g)+3H2(g) 2NH3(g);△H=-92.0kJ/mol 。
2NH3(g);△H=-92.0kJ/mol 。

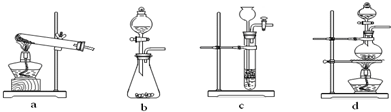
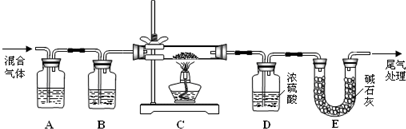
 CO (g) +H2 (g) △H= +131.3 kJ?mol-1(······①
CO (g) +H2 (g) △H= +131.3 kJ?mol-1(······①