题目内容
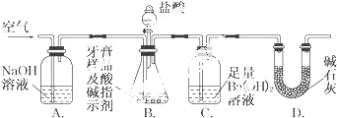
【题目】(1)写出下列物质在水溶液中电离的方程式:
HNO3_______________________________;HClO___________________________________;
NaHCO3__________________________________、___________________________________。
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(3)己知:①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
①上述反应中属于放热反应的是________________________________________________。
②H2的燃烧热为_____________________,C的燃烧热为____________________________。
③燃烧l0gH2 生成液态水,放出的热量为________________________________________。
④CO的燃烧热为___________,其热化学方程式为_________________________________。
【答案】 HNO3=H++NO3- HClO![]() H++ClO- NaHCO3=Na++HCO3- HCO3-
H++ClO- NaHCO3=Na++HCO3- HCO3-![]() H++CO32- CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH= -725.76 kJ·mol-1 ①②③④ 285.8 kJ·mol-1 393.5 kJ·mol-1 1429 kJ 283 kJ·mol-1 CO(g)+1/2O2(g)=CO2(g) ΔH= -283 kJ·mol-1
H++CO32- CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH= -725.76 kJ·mol-1 ①②③④ 285.8 kJ·mol-1 393.5 kJ·mol-1 1429 kJ 283 kJ·mol-1 CO(g)+1/2O2(g)=CO2(g) ΔH= -283 kJ·mol-1
【解析】(1).硝酸是强酸,属于强电解质,在水溶液中完全电离,电离方程式为:HNO3=H++NO3-;次氯酸是弱酸,属于弱电解质,在水溶液中部分电离,方程式为:HClO![]() H++ClO-;NaHCO3是盐,属于强电解质,在溶液中完全电离生成钠离子和碳酸氢根离子,碳酸氢根离子部分电离生成氢离子和碳酸根离子,方程式为:NaHCO3=Na++HCO3-,HCO3-
H++ClO-;NaHCO3是盐,属于强电解质,在溶液中完全电离生成钠离子和碳酸氢根离子,碳酸氢根离子部分电离生成氢离子和碳酸根离子,方程式为:NaHCO3=Na++HCO3-,HCO3-![]() H++CO32-,故答案为:HNO3=H++NO3-;HClO
H++CO32-,故答案为:HNO3=H++NO3-;HClO![]() H++ClO-;NaHCO3=Na++ HCO3-;HCO3-
H++ClO-;NaHCO3=Na++ HCO3-;HCO3-![]() H++CO32-;
H++CO32-;
(2).1mol甲醇的质量是1mol×32g/mol=32g,因1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则1mol甲醇燃烧时放出热量(32×22.68)kJ=725.76kJ,则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH= -725.76 kJ·mol-1,故答案为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH= -725.76 kJ·mol-1;
(3).①.放热反应的△H<0,所以上述四个反应都是放热反应,故答案是:①②③④;
②.燃烧热指的是1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,则C、H元素完全燃烧应分别生成CO2(g)、H2O(l),所以H2的燃烧热为285.8 kJ·mol-1,C的燃烧热为393.5 kJ·mol-1,故答案为:285.8 kJ·mol-1;393.5 kJ·mol-1;
③.根据氢气的燃烧热可知,1molH2完全燃烧生成液态水时放出热量285.8kJ,10g H2的物质的量是5mol,则燃烧10g H2生成液态水时放出热量(5×285.8)kJ=1429kJ,故答案为:1429 kJ;
④.根据盖斯定律,将④-③得:CO(g)+1/2O2(g)=CO2(g) ΔH= -283 kJ·mol-1,根据燃烧热的定义可知,CO的燃烧热为283 kJ·mol-1,故答案为:283 kJ·mol-1;CO(g)+1/2O2(g)=CO2(g) ΔH= -283 kJ·mol-1。

【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: 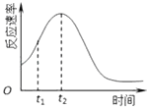
①;②
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.