题目内容
(6分)已知:
① CaCO3 (s) ![]() CaO (s) + CO2 (g) Δ H = +178.2 kJ·mol-1
CaO (s) + CO2 (g) Δ H = +178.2 kJ·mol-1
② 2Na (s) + Cl 2 (g) ![]() 2NaCl (s) Δ H = -822.0 kJ·mol-1
2NaCl (s) Δ H = -822.0 kJ·mol-1
③ H-H、Cl-Cl和 H-Cl的键能分别为436 kJ·mol-1、243 kJ·mol-1和431 kJ·mol-1
则:ww w.ks 5u.co m
(1)上述反应①②中属于放热反应的是 (填序号)。
(2)根据②计算生成1 mol NaCl(s)时,Δ H = ____ kJ·mol-1。
(3)根据③推算:Cl 2 (g) + H2 (g) ![]() 2HCl (g) 的Δ H = kJ·mol-1。
2HCl (g) 的Δ H = kJ·mol-1。
(1) ② (填序号)。(2)Δ H = -411.0 kJ·mol-1。(3)Δ H = -183.0kJ·mol-1。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示).
(2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示).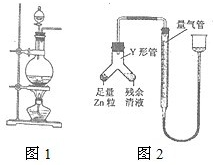 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).