题目内容
【题目】向0.5L 0.4mol/L的NaClO溶液中缓慢通入0.1mol CO2根据右表提供的数据,下列判断不正确的是

A. 原溶液中:c(ClO-)>c(OH-)>c(H+)
B. 原溶液中c(OH-)=c(H+)+c(HClO)
C. 反应后溶液中c(HClO)>c(HCO3-)>c(ClO-)>c(CO32-)
D. 反应后溶液中c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)+c(ClO-)+c(HClO)
【答案】D
【解析】根据表中数据可知酸性:H2CO3>HClO>HCO3-。次氯酸钠的物质的量是0.2mol,与0.1molCO2反应的方程式为:NaClO+CO2+H2O=HClO+NaHCO3,即所得溶液是等浓度的次氯酸钠、次氯酸和碳酸氢钠的混合溶液。A.次氯酸钠水解,溶液显碱性,则原溶液中:c(ClO-)> c(OH-)> c(H+),A正确;B.根据质子守恒可知原溶液中:c(OH-)=c(H+)+c(HClO),B正确;C.次氯酸钠的水解程度大于碳酸氢钠,则反应后溶液中c(HClO)>c(HCO3-)>c(ClO-)>c(CO32-),C正确;D.根据物料守恒可知反应后溶液中:c(Na+)=c(ClO-)+c(HClO),D错误,答案选D。

练习册系列答案
相关题目
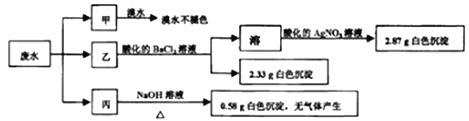
【题目】工业上制取CuCl2的生产流程如下:

请结合下表数据,回答下列问题:
物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
⑴ 溶液A中加入NaClO的目的是 ;
此反应离子方程式为 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。