题目内容
20.写出下列反应的离子方程式①FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-;
②FeBr2溶液中通入与其等物质的量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;
③FeBr2溶液中通入足量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-..
分析 还原性Fe2+>Br-,氯气少量时,亚铁离子优先反应;氯气足量时,亚铁离子和溴离子都参与反应;氯气与溴化亚铁的物质的量相等时,亚铁离子先被氧化,剩余的氯气再氧化溴离子,据此进行解答.
解答 解:①FeBr2溶液中通入少量Cl2,只有亚铁离子被氧化,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
②还原性Fe2+>Br-,FeBr2溶液中通入与其等物质的量的氯气,亚铁离子全部被氧化,溴离子一半被氧化,反应的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,
故答案为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;
③FeBr2溶液中通入足量Cl2,亚铁离子和溴离子都被氧化,反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,
故答案为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-.
点评 本题考查离子方程式的书写,题目难度中等,明确发生反应的先后顺序为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
10.下列分子中含手性碳原子的是( )
| A. |  | B. | CH3-CH2-CH3 | C. | CH3-CH2-CH2-OH | D. |  |
11.下列关于“反应先后顺序”的评价中正确的是( )
| A. | 足量铜与一定量浓硫酸加热反应,先产生二氧化硫,后产生氢气 | |
| B. | 向Ba(OH)2溶液中通CO2至过量,先生成白色沉淀,后沉淀溶解 | |
| C. | 向(NH4)2Fe(SO4)2溶液中滴加少量NaOH溶液,NH4+先发生反应 | |
| D. | 向等浓度的FeCl3和CuCl2混合溶液中加入少量Fe粉,Cu2+先被还原 |
15.下列电子式书写错误的是( )
| A. |  | B. |  | C. | 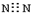 | D. |  |
5.下列物质的能导电,且属于电解质的是( )
| A. | 盐酸 | B. | 石墨 | C. | 液态CO2 | D. | NaCl(熔融) |
14. 一定质量的Na、K分别投入足量的同浓度、同体积的稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中不正确的是( )
一定质量的Na、K分别投入足量的同浓度、同体积的稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中不正确的是( )
 一定质量的Na、K分别投入足量的同浓度、同体积的稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中不正确的是( )
一定质量的Na、K分别投入足量的同浓度、同体积的稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中不正确的是( )| A. | 曲线a对应的反应使用了催化剂 | |
| B. | 投入的Na、K物质的量相等 | |
| C. | 曲线a代表K的反应,曲线b代表Na的反应 | |
| D. | 两反应中反应速率不同的主要原因是反应物自身的性质不同 |
 ,其化学键属极性共价键(填“极性”或“非极性”).
,其化学键属极性共价键(填“极性”或“非极性”).