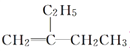题目内容
【题目】一同学欲从量筒中取出部分液体,他先俯视凹液面的最低处,读数为50mL,倒出液体后,他又仰视凹液面的最低处,读数为10mL他实际倒出液体的体积为
A. 40mL B. 大于40mL C. 小于40mL D. 不一定
【答案】C
【解析】俯视凹液面的最低处时,看到的读数偏大,但量取的实际体积正好偏小,如果读数为50mL,实际小于50ml,假设为49mL,仰视凹液面的最低处,看到的读数偏小,但量取的实际液体偏大,由凹液面的最低处读数为10ml,实际比10ml大,假设11mL,所以倾出液体的体积是49mL-11mL=38mL,小于40mL,故选C。

【题目】如表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为 .
(2)表中元素原子半径最大的是(写元素符号) .
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 .
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔、沸点分别为﹣69℃和58℃.写出该反应的热化学方程式: .
(5)碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为 . Q与水反应的化学方程式为 .
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2molL﹣1 NaOH溶液和1mol O2 , 则两种气体的分子式及物质的量分别为 , 生成硫酸铜物质的量为 .