题目内容
将8g铁片放入100 mL CuSO4溶液中,Cu2+全部被置换后,取出附有铜的铁片洗涤、干燥、称重,其质量变为8.2g,则原溶液中CuSO4的物质的量浓度是
| A.0.125ol/L | B.0.175mol/L | C.0.25 mol/L | D.0.5 mol/L |
C
解析试题分析:铁与硫酸铜溶液反应的离子方程式为:Fe+Cu2+=Fe2++Cu.由方程式可看出:若有56克铁参加反应,就消耗1mol硫酸铜,产生64克铜。即:反应前后固体质量增加8克,就有1mol硫酸铜反应、现在固体质量增加了8.2-8=0.2克,所以反应的硫酸铜的物质的量为:(0.2/8)×1mol=0.025mol.所以C(CuSO4)=n/V=0.025mol/0.1L=0.25mol/L.选项为:C.
考点:考查量差法进行化学计算的知识。

 名校课堂系列答案
名校课堂系列答案将0.1mol·L-1K2SO4溶液、0.2mol·L-1Fe2(SO4)3溶液与水混合,欲使混合溶液中K+、Fe3+、SO42-物质的量浓度为0.1mol·L-1、0.1mol·L-1、0.2mol·L-1,则所用的K2SO4溶液,Fe2(SO4)3溶液、水的体积比约为( )
| A.1:1:1 | B.2:1:1 | C.1:1:2 | D.2:1:2 |
下图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是 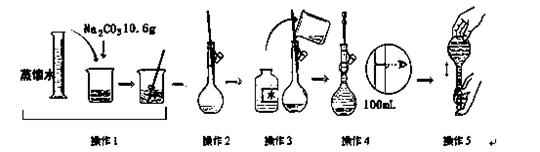
| A.所配制的Na2CO3溶液的物质的量浓度为1 mol/L |
| B.操作2是将溶解的Na2CO3溶液转移到容量瓶中 |
| C.操作4是滴加水至溶液凹液面的最低点与刻度线平齐 |
| D.操作5中,摇匀后发现液面低于刻度线,则要继续加水至液面与刻度线平齐 |
下列溶液中Cl-的物质的量浓度和Cl-的物质的量与50 mL 1 mol·L-1的AlCl3溶液中Cl-物质的量浓度和Cl-的物质的量都相等的是
| A.75 mL 2 mol·L-1 的NH4Cl | B.150 mL 1 mol·L-1 的NaCl |
| C.50 mL 1.5 mol·L-1 的CaCl2 | D.50 mL 3 mol·L-1 的KClO3 |
Cu、Cu2O和CuO组成的混合物,加入100 mL 0.6mol/LHNO3溶液恰好使混合物溶解,同时收集到224 mLNO气体(标准状况)。下列说法不正确的是
| A.产物中硝酸铜的物质的量为0.025 mol |
| B.若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol |
| C.若混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量均为0.005 mol |
| D.混合物中Cu的物质的量的取值范围为0.005mol<n(Cu)<0.015mol |
下列各组中的两种气体的分子数一定相同的是
| A.质量相等但密度不等的N2和C2H4 | B.体积相同的N2和C2H4 |
| C.等温、等体积的N2和O2 | D.等压、等体积N2和CO2 |
将3.52克CO2和SO2混合气体通入一定量的NaOH溶液中,气体全部与NaOH反应生成盐,将反应后的溶液减压低温蒸干后得到不含结晶水的固体,固体的质量可能为
| A.8.48克 | B.7.48克 | C.5.72克 | D.5.22克 |
将9.0 g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8 g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
| A.原混合物中铜和铁各0.075mol |
| B.稀硝酸的物质的量浓度为0.5mol·L-1 |
| C.第一次剩余4.8g金属为铜和铁 |
| D.再加入上述100mL稀硝酸,又得到标准状况下1.12L NO |
下列叙述正确的是
| A.H2SO4的摩尔质量是98 |
| B.等物质的量的O2和O3中所含的氧原子数相同 |
| C.等质量的CO与CO2中所含碳原子数相同 |
| D.将98g H2SO4溶解于水配成500mL溶液,所得溶液中硫酸的物质的量浓度为2 mol/L |