��Ŀ����
����Ŀ����A��B��C��D����Ԫ�أ�AԪ���γɵ�������ֻ��һ�����ӣ�Bԭ�ӵ������������Ǵ�����3����CԪ�ص�һ�������Ӻ�����10�����ӣ�DԪ�ص�ԭ�ӵõ�һ�����Ӻ����γ����ԭ�ӵ��Ӳ�ṹ��ͬ�����ӡ��ش��������⣺
(1)����DԪ�ص����ӽṹʾ��ͼ________��C2B2�ĵ���ʽΪ___________��
(2)��B��C��D����Ԫ����ɵĻ������к��еĻ�ѧ����______________��
(3))A��B���γɵ�������ͬ���������ӣ����������ӷ�Ӧ������һ�����Է��ӣ���Ӧ�����ӷ���ʽ��_________________________��
���𰸡� 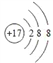
![]() ���Ӽ������ۼ� H3O����OH��===2H2O
���Ӽ������ۼ� H3O����OH��===2H2O
����������A��B��C��D����Ԫ�أ�AԪ���γɵ�������ֻ��һ�����ӣ���A��HԪ�أ�Bԭ�ӵ������������Ǵ�����3������BԪ����OԪ�أ�CԪ�ص�һ�������Ӻ�����10�����ӣ���C��NaԪ�أ�DԪ�ص�ԭ�ӵõ�һ�����Ӻ����γ����ԭ�ӵ��Ӳ�ṹ��ͬ�����ӣ���D��ClԪ�أ�
��1�������Ӻ�����3�����Ӳ㣬�������8�����ӣ����������ӽṹʾ��ͼΪ�� ��C2B2��Na2O2,���ĵ���ʽΪ:
��C2B2��Na2O2,���ĵ���ʽΪ: ![]()
(2)��B��C��D����Ԫ����ɵĻ�������NaClO�� NaClO3�ȣ����н���Ԫ�أ�Ҳ�зǽ���Ԫ�أ����仯�����еĻ�ѧ�������Ӽ������ۼ���
(3))A��B���γɵ�������ͬ���������ӣ����������ӷ�Ӧ������һ�����Է��ӣ������������ҷֱ���H3O����OH������Ӧ�����ӷ���ʽ��H3O����OH��===2H2O��

����Ŀ��ij�¶�ʱ����2 L�ܱ������У�������̬����X��Y��Z�����ʵ�����n����ʱ�䣨t���仯��������ͼ��ʾ����ͼ�����ݷ����ɵã�
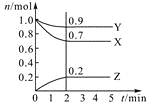
��1���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ��ʼ��2 min����Y��ʾ��ƽ����Ӧ����Ϊ ��X��ת����Ϊ ��
��3����һ���¶��£������������Ϊ������Ӧ�ﵽ��Ӧ�ȵı�־���� ��
A��X��Y��Z��Ũ����� |
B��X��Y��Z�ķ�������Ϊ3�U1�U2 |
C��Z������������Y���������ʵĶ��� |
D����λʱ��������n mol Y��ͬʱ����3n mol X |
��4�����ܱ������ͨ��a mol A��g����b mol B��g����
������ӦA��g��+ B��g��= 2C��g�������ı���������ʱ����ӿ췴Ӧ���ʵ��� ������ţ���
�������¶�
������������������䣬���뺤��
���������
������������������䣬����A��g�������ʵ���