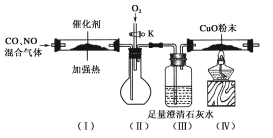
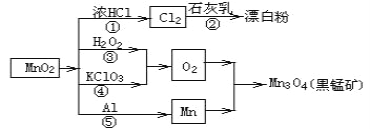
题目内容
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是
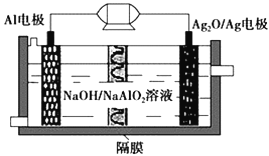
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子数目为0.1NA
C. Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O
D. 工作时电解液中的Na+移向Ag2O/Ag电极
【答案】B
【解析】
A.原电池工作时,正极发生还原反应,该反应中氧化银被还原为银,正极质量减少,A正确;
B.Ag2O中Ag的化合价为+1价,被还原单质银为0价,当电极上析出1.08gAg即0.01mol时,电路中转移的电子为0.01mol,电子数目为0.01NA,B错误;
C.原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,C正确;
D.铝为负极,Ag2O/Ag为电池的正极,原电池工作时阳离子向正极移动,即Na+向Ag2O/Ag极移动,D正确;
答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目