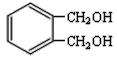
题目内容
【题目】下列反应中,不属于加成反应的是( )
A.在一定条件下苯与液溴反应制取溴苯
B.苯与浓硝酸、浓硫酸混合共热制取硝基苯
C.在一定条件下,乙烯与氯化氢反应制取氯乙烷
D.苯在镍的催化作用下与氢气反应得到环己烷
【答案】AB
【解析】
A.在一定条件下苯与液溴反应制取溴苯,苯中的H被Br取代,是取代反应,A选项满足题意;
B.苯与浓硝酸、浓硫酸混合共热制取硝基苯,苯中的H被硝基取代,是取代反应,B选项满足题意;
C.一定条件下,乙烯与氯化氢反应制取氯乙烷,乙烯中碳碳双键转化为单键,是加成反应,C选项不满足题意;
D.苯在镍的催化作用下与氢气反应得到环己烷发生的是加成反应,D选项不满足题意;
答案选AB。

【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.77×10 -4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液
A.HCOONa B.NaCN C.Na2CO3,
其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为__________________________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是______________________。
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是:
______________________________,溶液中![]() =___________。
=___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=_____(用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =___________(保留三位有效数字)。
=___________(保留三位有效数字)。