题目内容
完成下列2个小题:
(1)配平下列反应方程式______KMnO4+______SO2+______H2O═______MnSO4+______K2SO4+______H2SO4
(2)用双线桥标出下列反应的电子转移方向和数目:S+2H2SO4(浓)
3SO2+2H2O
该反应中氧化剂是______(填化学式),S表现______性,H2SO4发生______反应,氧化产物与还原产物物质的量之比为______.
(1)配平下列反应方程式______KMnO4+______SO2+______H2O═______MnSO4+______K2SO4+______H2SO4
(2)用双线桥标出下列反应的电子转移方向和数目:S+2H2SO4(浓)
| ||
该反应中氧化剂是______(填化学式),S表现______性,H2SO4发生______反应,氧化产物与还原产物物质的量之比为______.
(1)Mn元素的化合价是从+7价降低到了+2价,降低了5,硫元素的化合价从+4价升高到了+6价,升高了2价,所以Mn元素前边系数是2,SO2前边系数是5,根据原子守恒,硫酸锰前边系数是2,硫酸钾系数是1,水前边系数是2,
故答案为:2、5、2、2、1、2;
(2)氧化还原反应中,化合价升高值=化合价降低值=转移电子数=4,化合价降低元素S元素,化合价从+6降到了+4价,S元素化合价也从0价升高到了+4价,电子转移情况如下: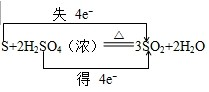 ,硫单质变现了还原性,硫酸中硫元素化合价降低,硫酸是氧化剂,发生还原反应,氧化产物和还原产物均是二氧化硫,氧化产物与还原产物物质的量之比为1:2,
,硫单质变现了还原性,硫酸中硫元素化合价降低,硫酸是氧化剂,发生还原反应,氧化产物和还原产物均是二氧化硫,氧化产物与还原产物物质的量之比为1:2,
故答案为: ;H2SO4;还原;还原;1:2.
;H2SO4;还原;还原;1:2.
故答案为:2、5、2、2、1、2;
(2)氧化还原反应中,化合价升高值=化合价降低值=转移电子数=4,化合价降低元素S元素,化合价从+6降到了+4价,S元素化合价也从0价升高到了+4价,电子转移情况如下:
 ,硫单质变现了还原性,硫酸中硫元素化合价降低,硫酸是氧化剂,发生还原反应,氧化产物和还原产物均是二氧化硫,氧化产物与还原产物物质的量之比为1:2,
,硫单质变现了还原性,硫酸中硫元素化合价降低,硫酸是氧化剂,发生还原反应,氧化产物和还原产物均是二氧化硫,氧化产物与还原产物物质的量之比为1:2,故答案为:
 ;H2SO4;还原;还原;1:2.
;H2SO4;还原;还原;1:2.
练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
 )。
)。 ①
①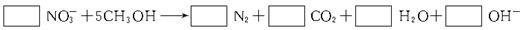
 Si+2CO↑,下列说法正确的是
Si+2CO↑,下列说法正确的是