题目内容
【题目】(1)白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1。
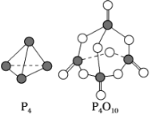
根据图示的分子结构和有关数据估算该反应的ΔH为________________。
(2)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+5/4O2(g)===1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是________;白磷的稳定性比红磷________(填“大”或“小”)。
【答案】(6a+5d-4c-12b)kJ·mol-1 红磷小
【解析】
(1)反应热△H=反应物总键能-生成物总键能,据此计算判断;
(2)根据盖斯定律可以计算化学反应的焓变,进而书写热化学方程式,比较能量高低;物质具有的能量越低越稳定。
(1)各化学键键能为P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。反应热△H=反应物总键能-生成物总键能,所以反应P4+5O2=P4O10的反应热△H=6akJmol-1+5dkJmol-1-(4ckJmol-1+12bkJmol-1)=(6a+5d-4c-12b)kJ·mol-1;
(2)已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
根据盖斯定律可知①-②×4即得到反应P4(白磷,s)=4P(红磷,s)的ΔH=-29.2 kJ·mol-1,这说明白磷转化为红磷放热,因此相同状况下,能量较低的是红磷;根据能量越低越稳定可知白磷的稳定性比红磷小。

 阅读快车系列答案
阅读快车系列答案【题目】W、X、Y、Z、M、G五种短周期元素,原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性。请回答下列问题:
(1)Y在元素周期表中的位置为___________;
(2) W、Y、Z、G形成的简单离子的半径大小顺序是___________(用化学符号表示)
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有________ (任写两个)
(4)ZW的电子式为___________,W2Y2的电子式为______
(5)MY2和G2均能使品红溶液褪色,常温常压下若将相同体积的MY2和G2气体同时通入品红溶液,请用相关离子方程式解释原因________。
(6)已知
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是是___________ ;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(7)最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是___________ 。

A.N4属于一种新型化合物 B.N4晶体熔点高,硬度大
C.相同质量的N4的能量高于N2 D.1molN4转变为N2将吸收882kJ的能量