题目内容
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
(1)A的基态原子最外层有 种不同运动状态的电子,F位于 区。
(2)E2+的基态核外电子排布式为 ,AD4为 (填极性或非极性)分子。
(3)A、B、C三种元素的电负性由小到大的顺序是 (用元素符号表示),B和C两元素中,B的第一电离能较大的原因是 ,与AC2互为等电子体的分子的名称为 。(只写一种)
(4)BD3 中心原子的杂化方式为 ,其分子空间构型为 。
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为 ;F的原子半径是 pm;(阿伏加德罗常数为NA)。
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(2)E2+的基态核外电子排布式为 ,AD4为 (填极性或非极性)分子。
(3)A、B、C三种元素的电负性由小到大的顺序是 (用元素符号表示),B和C两元素中,B的第一电离能较大的原因是 ,与AC2互为等电子体的分子的名称为 。(只写一种)
(4)BD3 中心原子的杂化方式为 ,其分子空间构型为 。
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为 ;F的原子半径是 pm;(阿伏加德罗常数为NA)。

(1)4(1分),ds(1分)
(2)1s2 2s2 2p6 3s2 3p63d5或【Ar】3d5(2分),非极性(1分)
(3)C < N< O(1分) ,B为N,C为O,N原子价电子排布为2s22p3,而O原子的价电子排布为2s22p4,N原子2p轨道半充满,较稳定。(2分) 一氧化二氮(1分)
(4)sp3 三角锥形 (各1分)
(5) 12 ;(1分)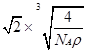 ×1010;(3分)
×1010;(3分)
(2)1s2 2s2 2p6 3s2 3p63d5或【Ar】3d5(2分),非极性(1分)
(3)C < N< O(1分) ,B为N,C为O,N原子价电子排布为2s22p3,而O原子的价电子排布为2s22p4,N原子2p轨道半充满,较稳定。(2分) 一氧化二氮(1分)
(4)sp3 三角锥形 (各1分)
(5) 12 ;(1分)
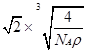 ×1010;(3分)
×1010;(3分)试题分析:A原子核外电子分占3个不同能级,即1s、2s和2p能级,且每个能级上排布的电子数相同,则每个能级上各有2个电子,故A为C;B元素原子的核外p电子总数比s电子总数少1,B元素的s电子有4个,则p电子有3个,故B为N;C原子p轨道上成对电子数等于未成对电子数,且与A同周期,则p轨道上有4个电子,C为O;D元素的族序数与周期数的差为4,且不与A元素在同一周期,故D为第三周期,族序数为7,则D为Cl;E位于周期表中第七列,第四周期,故E为Mn;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,故F为Cu;(1)A的基态原子最外层有4个电子,故有四种不同的运动状态;F为Cu,位于ds区;(2)E为Mn,失去4s层两个电子,故核外电子排布为1s2 2s2 2p6 3s2 3p6 3d5;AD4为CCl4,非极性化合物;(3)C、N、O三者的电负性大小为C < N< O;因N原子2p轨道半充满,故较难失去一个电子,因此比O原子稳定;AC2为CO2,等电子体为N2O;BD3为NCl3,中心原子采用sp3杂化,分子结构为三角锥形;(4)配位数为12个,以最上面中心为例,同一层上四个角,加上下面4个面中心四个,和上面4个面对应的4个,总共12个;设F原子的半径为r cm,晶胞的边长为a cm,则可以得到a=2
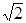 r,根据m=ρν=nM可得:ρg/cm3×a3 cm3=4÷NA×64g/mol,将a=2
r,根据m=ρν=nM可得:ρg/cm3×a3 cm3=4÷NA×64g/mol,将a=2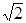 r代入可求得:r=
r代入可求得:r=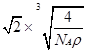 ×1010
×1010点评:物质的结构是高考历年的重点,考生在备考中要注意区分各概念,熟练运用概念进行相关的判断。理论性强,难度较大。

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目

 键的数目之比为 。
键的数目之比为 。








