题目内容
5.2014年,电池发展国际峰会召开,选定天津为金属空气电池研究基地.金属空气电池材料来源广,安全环保,能量密度大,是“面向21世纪新型绿色能源”可作为混合动力车的供电系统.Zn空气电池是利用较广的一种空气电池,放电时总反应方程为:2Zn+O2=2ZnO,其构造结构如图所示,下列说法正确的是( )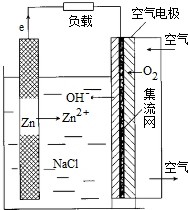
| A. | 放电时,电池正极反应式为:O2+H++4e-=2H2O | |
| B. | 增大空气进气口直径,可增大电池输出能力并延长电池使用寿命 | |
| C. | 放电时,每通入2.24L空气(标准状况),理论上负极需要消耗13gZn | |
| D. | 电池用完后,只需更换封装好的锌粉或电池锌板即可 |
分析 A、放电时,正极发生还原反应,电解质溶液中无氢离子,电极反应式为:O2+2H2O+4e-=4OH-;
B、增大空气进气口直径,可增大电池输出能力,但缩短了电池的寿命;
C、每通入2.24L空气(标准状况),所以氧气的物质的量为:0.1×$\frac{1}{5}$=0.02mol,则转移电子的物质的量为:0.04mol,参加反应的锌为0.02mol;
D、因为负极锌失去电子变成锌离子,所以只要补充负极材料即可.
解答 解:A、放电时,正极发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故A错误;
B、增大空气进气口直径,可增大电池输出能力,锌的消耗速度加快,所以缩短了电池的寿命,故B错误;
C、每通入2.24L空气(标准状况),所以氧气的物质的量为:0.1×$\frac{1}{5}$=0.02mol,则转移电子的物质的量为:0.04mol,参加反应的锌为0.02mol,所以参加反应的锌为0.02mol×65g/mol=1.3g,故C错误;
D、因为负极锌失去电子变成锌离子,所以只要补充负极材料即可,故D正确;
故选D.
点评 本题考查了原电池的反应原理和电极反应方程式的书写,相关计算学生要抓住电子守恒分析解答,比较容易.

练习册系列答案
相关题目
15. 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
Ⅱ.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ/mol.
(2)2NH3(g)?N2(g)+3H2(g)在恒容密闭容器中达到平衡的标志有:C.
①单位时间内生成3n mol H2同时生成2n mol NH3
②用NH3、N2、H2表示反应速率比为2:1:3
③混合气体的密度不再改变
④混合气体压强不再改变
⑤混合气体平均相对分子质量不再改变
A.①③④B.①②④⑤C.①④⑤D.②③④
(3)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
①20min时,υ正(CO2 )>80min时υ逆(H2O)(填“>”、“=”或“<”).
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为76.53(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象.保持其它条件不变,则(t+10)℃下正确的图象可能是B(填图甲中的“A”或“B”).
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
Ⅱ.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ/mol.
(2)2NH3(g)?N2(g)+3H2(g)在恒容密闭容器中达到平衡的标志有:C.
①单位时间内生成3n mol H2同时生成2n mol NH3
②用NH3、N2、H2表示反应速率比为2:1:3
③混合气体的密度不再改变
④混合气体压强不再改变
⑤混合气体平均相对分子质量不再改变
A.①③④B.①②④⑤C.①④⑤D.②③④
(3)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为76.53(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象.保持其它条件不变,则(t+10)℃下正确的图象可能是B(填图甲中的“A”或“B”).
13. 在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )
在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )
 在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )
在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )| A. | 反应的平均速率v(A)=0.04 mol/(L•min) | |
| B. | 达平衡时A、B的转化率相等 | |
| C. | 向平衡混合物中再加入0.1 mol A、0.2 mol B,达新平衡时C的体积分数减小 | |
| D. | 若升高温度达新平衡后,A的浓度增大,则△H>0 |
10.常温离子液体也称常温熔融盐,硝酸乙基铵[(C2H5NH3)NO3]是人类发现的第一种常温离子液体,其熔点为12℃.已知C2H5NH2的化学性质与NH3相似,C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是( )
| A. | 硝酸乙基铵水溶液呈碱性 | |
| B. | 该离子液体可以作为电池的电解质 | |
| C. | (C2H5NH3)NO3能与氢氧化钠反应产生NH3 | |
| D. | 相同温度下,相同物质的量的浓度的硝酸乙基铵溶液和硝酸铵溶液相比前者的pH小 |
17.化学与生活、环境保护、资源利用等密切相关.下列说法不正确的是( )
| A. | NO2或SO2都会导致酸雨的形成 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
14.分子式为C5H10O2,能与NaOH反应且有3个甲基的同分异构体共有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |