题目内容
15.如图是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式2Mg+CO2点燃_点燃–––––2MgO+C.
(2)D的气态氢化物的VSEPR模型为四面体,其中心原子的杂化类型为sp3.
(3)G、H和I的第一电离能数值由大到小的顺序为:Mg>Al>Na(用元素符号作答).
(4)由A、C、D形成的ACD分子中,含有2个σ键,2个π键.
(5)要证明太阳上是否含有R 元素,可采用的方法是对太阳光进行光谱分析.
(6)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有K、Cu(填元素符号)
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是非极性(填“极性”或“非极性”)分子.
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有C2H4、CH2O(填分子式).
分析 根据元素在周期表中的位置知,从A-R分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Cr、Fe、He元素,
(1)H单质是镁,镁在二氧化碳中燃烧生成氧化镁和C;
(2)D的气态氢化物是氨气,氨气分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断VSEPR模型和原子杂化方式;
(3)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(4)由A、C、D形成的ACD分子中为HCN,其结构式为H-C≡N,共价单键为σ键、共价三键中含有一个σ键、两个π键;
(5)采用光谱分析可以确定元素;
(6)①M是Cr元素,其原子最外层有1个电子;
②非极性分子的溶质极易溶于非极性分子的溶剂;
③根据价层电子对互斥理论判断原子杂化方式.
解答 解:根据元素在周期表中的位置知,从A-R分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Cr、Fe、He元素,
(1)H单质是镁,镁在二氧化碳中燃烧生成氧化镁和C,方程式为2Mg+CO2点燃_点燃–––––2MgO+C
,故答案为:2Mg+CO2点燃_点燃–––––2MgO+C;
(2)D的气态氢化物是氨气,氨气分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论知VSEPR模型为四面体,N原子杂化方式为sp3,故答案为:四面体;sp3;
(3)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能Mg>Al>Na,故答案为:Mg>Al>Na;
(4)由A、C、D形成的ACD分子中为HCN,其结构式为H-C≡N,共价单键为σ键、共价三键中含有一个σ键、两个π键,所以该分子中含有两个σ键、两个π键,故答案为:2;2;
(5)采用光谱分析可以确定元素,所以可以采用光谱分析确定He元素,故答案为:对太阳光进行光谱分析
;
(6)①M是Cr元素,其原子最外层有1个电子,所以与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有K、Cu,故答案为:K、Cu;
②非极性分子的溶质极易溶于非极性分子的溶剂,溶质都是非极性分子,所以MO2Cl2是非极性分子,故答案为:非极性;
③CCl4、CH3Cl中C原子价层电子对个数是4,采用sp3杂化,C2H4、CH2O碳原子价层电子对个数是3,为sp2杂化,CS2中C原子价层电子对个数是2,采用sp杂化,
故答案为:C2H4、CH2O.
点评 本题考查物质结构和性质,涉及原子杂化方式判断、相似相溶原理、元素周期律、物质性质等知识点,侧重考查基本理论,熟悉价层电子对互斥理论、元素周期律即可解答,注意第一电离能中的异常现象,题目难度不大.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是最内层电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
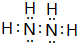 ;
;(2)用元素符号表示上述四种元素原子半径的相对大小S>Cl>C>N;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是ab
a、一定条件下Z的单质和T的单质分别与Fe发生反应产物类型不同
b、T的氢化物水溶液在空气中放置容易变质,而Z的氢化物水溶液不易变质
c、元素Z和T的最高价氧化物对应水化物都能与氢氧化钠溶液反应
(4)元素T的氢化物与其最高价氧化物对应的水化物的浓溶液加热条件下反应生成它的一种氧化物,写出该反应的化学方程式H2S+3H2SO4(浓)△_△––––––4SO2+4H2O.
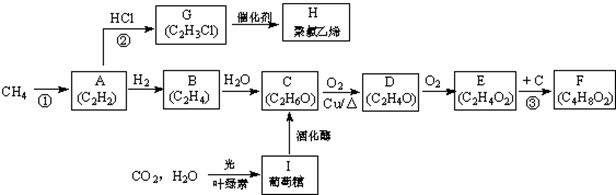
(1)反应②的类型为消去反应,E的官能团的名称羧基
(2)写出结构简式,D为CH3CHO,H为
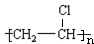
(3)由E生成F的化学方程式为CH3COOH+C2H5OH→浓硫酸△→浓硫酸△CH3COOC2H5+H2O,由I生成C的化学方程式为C6H12O6(葡萄糖)酒化酶→酒化酶→2C2H5OH+2CO2
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如下表
| 共价键 | H-H | C-H | C≡C |
| 能量变化/kJ•mol-1 | 436 | 413 | 812 |
| A. | 天然气的主要成分是甲烷 | |
| B. | 煤是由有机物和无机物组成的复杂的混合物 | |
| C. | 含C18以上烷烃的重油经裂化可以得到汽油 | |
| D. | 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 |
| 选项 | 事实 | 结论 |
| A | 完全燃烧产物是CO2和H2O的物质 | 一定只含C、H元素 |
| B | 灼烧棉织品、羊毛衫和涤纶衣物 | 有烧焦羽毛气味的是羊毛衫 |
| C | 在淀粉溶液中加入市售的加碘食盐不出现蓝色 | 说明此盐一定不含碘 |
| D | 甲乙两种有机物,相对分子质量相同,结构不同 | 甲和乙一定是同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙烯分子的最简式:CH2 | B. | 己烷的分子式:C6H12 | ||
| C. | 羟基的化学式:OH- | D. | 1,2-二溴乙烷的结构简式:C2H4Br2 |
| A. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| C. | 达到化学平衡时,N2将完全转化为NH3 | |
| D. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| A. | 聚苯乙烯单体的分子式为C8H8 | |
| B. | 聚苯乙烯属于纯净物 | |
| C. | 聚苯乙烯能与溴水发生加成反应 | |
| D. | 聚苯乙烯是可降解塑料,不会造成白色污染 |
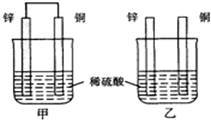
| A. | 两烧杯中溶液的氢离子浓度均减小 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中铜片表面均有气泡产生 | D. | 甲、乙溶液均变蓝色 |