题目内容
将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如右
图所示。则下列说法不正确的是
| A.在100℃时,M的化学式为FeSO4·4H2O |
| B.FeSO4·7H2O晶体中有4种不同结合力的水分子 |
| C.FeSO4·H2O存在的最高温度为373℃ |
D.380℃的P加热至650℃时的化学方程式为:2FeSO4 Fe2O3+SO2↑+SO3↑ Fe2O3+SO2↑+SO3↑ |
B
解析试题分析:8.34 g FeSO4·7H2O 的物质的量是0.03mol。A、在100℃时,M的质量为6.72g,减少了1.62g水,剩余0.12mol的水,所以FeSO4与H2O的物质的量比是1:4,正确;B、晶体中水分子的结合力是相同的,错误;C、FeSO4·H2O中水的物质的量为0.03mol,其质量是5.1g,所以由图可知FeSO4·H2O存在的最高温度为373℃,正确;D、P点对应的物质的质量是4.56g,为FeSO4的质量,Q点的质量是2.4g为Fe2O3的质量,所以从P到Q发生反应的化学方程式为:2FeSO4 Fe2O3+SO2↑+SO3↑,正确,答案选B。
Fe2O3+SO2↑+SO3↑,正确,答案选B。
考点:考查对图像的分析能力,根据条件计算化学式、化学方程式

练习册系列答案
相关题目
NA代表阿伏加德罗常数,下列说法正确的是
| A.1L浓度为0.1 mol / L AlCl3溶液中含有的离子数是0.4NA |
| B.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA |
| C.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA |
| D.标准状况下,1.12L的SO3所含的原子数是0.2 NA |
在下列条件下,两瓶气体所含的原子数一定相等的是( )
| A.具有同压强、同体积的N2O和CO2 |
| B.具有同温度、同体积的CO和N2 |
| C.具有同体积、同密度的SO2和NO2 |
| D.具有同质量、不同密度的O2和O3 |
下列化学用语表示正确的是
A.N2分子的电子式: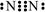 |
B.中子数为18的氯原子的原子符号: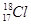 |
C.CH4分子的球棍模型: |
D.HOCH2COOH缩聚物的结构简式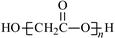 |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温常压下,8gO2含有4nA个电子 |
| B.1L0.1mol·L-1的氨水中有nA个NH4+ |
| C.标准状况下,22.4L盐酸含有nA个HCl分子 |
| D.1molNa被完全氧化生成Na2O2,失去个2nA电子 |
将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
| A.x=2.24 |
| B.钠的物质的量为0.2 mol |
| C.反应时,Na、Mg、Al均过量 |
| D.曲线b为Mg与盐酸反应的图像 |
下列选项中的物质所含指定原子数目一定相等的是
| A.温度和压强不同,相同质量的N2O和CO2两种气体的总原子数 |
| B.等温等压下,相同体积的C2H4和C2H2、C2H6的混合气体的总原子数 |
| C.等温等压下,相同体积的O2和O3两种气体中的氧原子数 |
| D.相同物质的量、不同体积的NH3和CH4两种气体中的氢原子数 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )。
| A.常温下,4 g CH4含有NA个C—H共价键 |
| B.1 mol Fe 与足量的稀HNO3反应,转移2NA个电子 |
| C.1 L 0.1 mol·L-1 NaHCO3溶液中含有0.1NA个HCO3- |
| D.常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |