题目内容
已知空气-锌电池的电极反应:
锌片:Zn-2OH--2e- = ZnO + H2O,石墨:1/2 O2+H2O +2e- = 2OH-
据次推断锌片是
| A.负极,被氧化 | B.负极,被还原 | C.正极,被氧化 | D.正极,被还原 |
A
解析试题分析:由于在反应中Zn失去电子被氧化,所以Zn为原电池的负极;在石墨电极上O2得到电子,被还原,发生还原反应,所以石墨电极为正极。因此选项是A。
考点:考查在空气-锌电池中Zn的作用及发生反应的知识。

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素 的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示。下列说法不正确的是( )
| A.电解时石墨电极应与直流电的正极相连 |
| B.阴极反应式为:HOOCCOOH+2H++2e-=OHCCOOH+H2O |
| C.电解时石墨电极上有O2放出 |
| D.电解一段时间后,硫酸溶液的pH不变化 |
把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ( )
| A.1︰2︰3 | B.3︰2︰1 | C.6︰3︰1 | D.6︰3︰2 |
下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( )
| A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 |
| B.同价态的阳离子,甲比乙的氧化性强 |
| C.甲能跟稀盐酸反应放出氢气而乙不能 |
| D.将甲、乙作电极组成原电池时,甲是正极 |
上海自主研发了一种氢燃料汽车。它是以30%KOH溶液为电解质的氢氧燃料电池,下列有关说法中,不正确的是( )。
| A.正极反应:O2 + 2H2O + 4e- ="==" 4OH- |
| B.当正极消耗22.4 L H2时,负极11.2 L O2消耗(相同条件) |
| C.发生氧化反应的是负极 |
| D.氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
电子表中电源常用银—锌微型电池,电极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH- 电池的总反应式为:Ag2O+Zn= 2Ag+ZnO,下列判断不正确的是
| A.锌为负极,Ag2O为正极 |
| B.锌发生还原反应,氧化银发生氧化反应 |
| C.原电池工作时,负极附近溶液的pH值减小 |
| D.原电池工作时,电子流动方向为Zn→Ag2O |
下列各组材料中,不能组成原电池的是 ( )
| | A | B | C | D |
| 两极材料 | Zn片、石墨 | Cu片、Ag片 | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | 硫酸溶液 | 硝酸银溶液 | 蔗糖溶液 | 稀盐酸 |
一种太阳能电池的工作原理示意图如下所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( ) 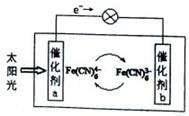
| A.K+移向催化剂b | B.催化剂a表面发生反应:Fe(CN)64――e-=Fe(CN)63- |
| C.Fe(CN)63-在催化剂b表面被氧化 | D.电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变 |