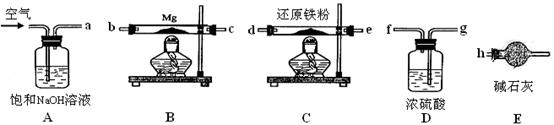
题目内容
某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。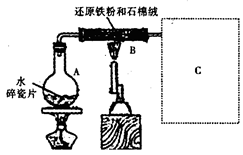
(1)装置B中发生反应的化学方程式是 。
(2)虚线框图C的气体收集装置是下图中的 (选填字母编号)。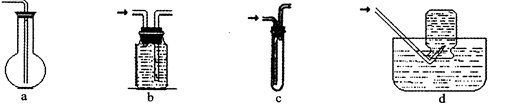
(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验: 
试剂a的化学式是 ,试剂b的化学式是 ;加入新制氯水后溶液红色加深的原因是(用离子方程式表示) 。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;假设2:
;为了对所提出的假设2进行验证,实验方案是
。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为 。
(1)3Fe + 4H2O 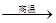 Fe3O4 + 4H2↑ (1分)
Fe3O4 + 4H2↑ (1分)
(2)bd (2分)
(3)KSCN ,NaOH;2Fe2++Cl2→2Fe3++2Cl- (1分1格,共3分)
(4)SCN-被过量的氯水氧化;(2分)
取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2不正确。(2分)
(5)77.8% (2分)
解析试题分析:(2)氢气难溶于水,可用排水法收集。选bd。
(3)因为铁和水反应生成Fe3O4,Fe3O4,+8HCl=2FeCl3+FeCl2+4 H2O 。淡黄色溶液含少量Fe3+,加a:KSCN,Fe3++3SCN- =Fe(SCN)3 少量淡红色。加新制的氯水,把FeCl2氧化变成FeCl3和KSCN生成
Fe(SCN)3,再加NaOH,能生成Fe(OH)3 。加热Fe(OH)3变成红棕色的Fe2O3
(4)“SCN-被过量的氯水氧化”,为证明此假设,需加过量的KSCN溶液,看是否变红。
(5)解设原铁元素的质量为x
2Fe------- Fe2O3
2*56 160
x 32 x=22.4
Fe%=22.4*100%/28.8=77.8%
考点:本题以化学实验为基础,考查实验设计、实验操作、分析和化学计算等知识。

 53随堂测系列答案
53随堂测系列答案人教版《必修1》关于Fe3+和Fe2+的转化的实验探究,某校教师为了检验学生完成每个实验过程时相应的问题解决思路,特设计一份化学探究学习“过程-思路”问卷。
(1)请在下表中右栏填写设计每一步操作过程的思路
| 过程 | 思路 |
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+ | ①根据氧化还原反应原理,一般 物质有还原性, 物质有氧化性 |
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色 | ②用离子方程式表示选择H2O2的原因 ③用离子方程式表示溶液变血红色的原因 |
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去 | ④选择铁粉的原因是 (用化学方程式表示) ⑤为什么要用煮沸的水 |
| 4.实施实验 | …… |
| …… | …… |
(2)教材中实验方案如下:取2mLFeCl3溶液,加入少量铁粉,充分反应后,滴入几滴KSCN溶液,观察并记录实验现象。把上层清液倒入另一试管中,再滴入几滴氯水,又发生了什么变化?学生通过实践证明,实验效果很差:没有预期的红色出现,而是很淡的浅红色,试分析实验中出现异常的可能原因并加以改进使实验现象更明显。
⑥可能的原因:
⑦改进措施:
青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2.青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
| A.青石棉是一种硅酸盐产品 |
| B.青石棉中含有一定量的石英晶体 |
| C.青石棉的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O |
| D.1 mol青石棉能使1 mol HNO3被还原 |
下列物品中,都用到硅单质的是
①陶瓷 ②硅太阳能电池 ③玛瑙 ④计算机芯片 ⑤光导纤维
| A.①③⑤ | B.②④ | C.③④ | D.②③⑤ |

 MgO+H2↑ Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
MgO+H2↑ Mg3N2 +6H2O =3Mg(OH)2+2NH3↑