题目内容
碳酸钙常用作牙膏的摩擦剂.某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)
回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨.标准状况下生成二氧化碳的体积为 L,石灰石中碳酸钙的质量分数为 %.
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为 .
(3)第③步反应一般不采用通入CO2的主要原因是 ,相应的离子方程式为 .
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是 .
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:
与前一方案相比较,该方案的优点是 .
(每空2分,共14分)
(1)2.24×107L ; 90.0 (4分)
(2)CaSiO3 (2分)
(3)通入CO2的量不易控制,使生成的碳酸钙在CO2过量的条件下溶解 (2分)
CaCO3+CO2+H2O=Ca2++2HCO3— (2分)
(4)5.6×105mol/L (2分)
(5)不需要加热,操作简单,减少来自燃料的污染(2分)
解析试题分析:
(1) 根据碳酸钙分解:
根据碳酸钙分解:
CaCO3 CaO + CO2 ↑ △m
CaO + CO2 ↑ △m
100 56 22.4 44
100×106g V 44×106g
所以生成二氧化碳的体积为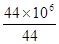 mol×22.4L/mol=2.24×107L
mol×22.4L/mol=2.24×107L
石灰石中碳酸钙的质量分数为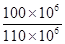 ×100%=90.9%
×100%=90.9%
(2)碳酸钙除了分解,还与少量杂质SiO2发生反应:SiO2+CaCO3=CaSiO3+CO2
所以不溶液性滤渣的成分有CaSiO3。
(3)因CO2过量时,会继续与碳酸钙反应,CaCO3+CO2+H2O═Ca2++2HCO3-(4)当溶液中QC≥KSP时,形成沉淀,C(Ca2+)≥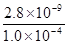 mol?L-1=2.8×10-5mol?L-1,
mol?L-1=2.8×10-5mol?L-1,
等体积混合前CaCl2溶液的物质的量浓度最小为5.6×10-5 mol?L-1
(5)因与前一方案相比较,可知制备过程不需要加热、操作简便等。
考点:考查了碳族元素的基本知识和实验方案设计,首先要学会分析流程图中各步试剂的作用和反应物生成物的成分,然后结合学过的相关知识进行分析。

 名校课堂系列答案
名校课堂系列答案下列实验操作均用到玻璃棒,其中玻璃棒的作用及其目的相同的是
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体
| A.①和② | B.①和③ | C.③和④ | D.①和④ |
下列化学实验事实及其解释都正确的是
| A.将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖 |
| B.分离苯和苯酚的混合液,因三溴苯酚不溶于水,所以可先加入适量浓溴水,再过滤、分液即可实现 |
| C.向碘水中滴加CCl4,振荡静置,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
| D.将SO2通入盐酸酸化的Ba(NO3)2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸 |
下列有关操作或判断正确的是( )
| A.配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高 |
| B.用托盘天平称取25.20 g NaCl |
| C.用100 mL的量筒量取5.2 mL的盐酸 |
| D.用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高 |
有关实验操作正确的是
| A.溴苯中混有溴:加入碘化钾溶液后分液 |
| B.除去SO2中的少量CO2:通过盛有饱和Na2CO3溶液的洗气瓶 |
| C.用玻璃棒在过滤器上搅拌以加速AgCl沉淀的洗涤 |
| D.中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,不影响测定结果 |
读下列药品标签,有关分析不正确的是
| 选项 | A | B | C | D |
| 物品标签 |  | 药品:××× |  |  |
| 分析 | 该试剂应装在橡胶塞的细口瓶中 | 该药品不能与皮肤直接接触 | 该物质受热易分解 | 该物质浓度为18.4mol/L |
下列有关说法中,不正确的是
| A.除去Fe(OH)3胶体中少量的NaCl,常用渗析的方法 |
| B.实验室中少量金属钠、钾常保存在汽油中 |
| C.中和滴定时要将滴定管洗净并用待盛溶液润洗2~3次 |
| D.将盐酸、KSCN溶液和Fe(OH)3溶液混合后,溶液显红色 |