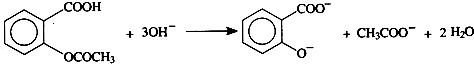
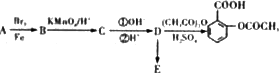
题目内容
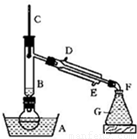
(10+6分)有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000 mL水,加入一定量的NaCl 固体溶解后通入SO2 气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入 约 10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如右下图。过一会儿:

(1)观察到试管中的液面逐渐下降,这说明
在该条件下,铁丝发生了 腐蚀,
正极材料是 电极反应是
(2)再过一段时间发现液面停止下降,并且开始逐渐
上升,露在液面上的铁丝表面由原来的银白色变棕褐色,这说明在该条件下,铁丝发生了
腐蚀,正极的电极反应为
①总反应为: ;① 反应的产物极易被进一步氧化,生成红褐色物质,② 该反应的化学方程式为: 若铁锈的组成为:Fe2O3·xH2O ,试写出由②反应的产物在通常条件下生成铁锈的反应方程式:
③
附加题(6分)(3)已知原来铁丝质量为2 g,发生(1)情况时,依液面下降的高度折为标准状况下的体积是5.6mL,则此时,铁丝的质量变为 g ,随后液面开始上升,即发生(2)的变化,依最终液面上升的高度折算为标准状况下的体积比最开始刚倒扣于水槽中试管中溶液的体积多了1.12mL,通过计算,(2)的过程共消耗氧气 mL,若x值为2,那么铁丝的质量应为 g(以上计算有效数字保留至小数点后三位)
(1)析氢,C或炭 2H++2e― → H2↑
(2) 吸氧 O2 + 4e― + 2H2O → 4OH―
① 2Fe + O2 + 2H2O = 2Fe(OH)2 ( 每空1分共6分)
② 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 ( 2分)
③ 2Fe(OH)3 = Fe2O3·xH2O +(3-x)H2O ( 2分)
附加题(每空2分,共6分)
(3)1.986 铁被溶解的物质的量即为氢气的物质的量,0.00025mol 即0.014g ,2-0.014=1.986
6.72 被吸收氧气的体积应为 5.6+1.12=6.72 mL
2.003 1.986+ 增加了氧的质量(0.0003×32)+增加水的质量(0.0004×18)=2.0028
【解析】略

 黄冈冠军课课练系列答案
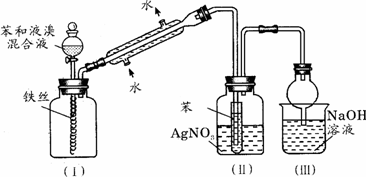
黄冈冠军课课练系列答案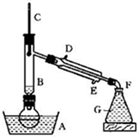 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4→NaHSO4+HBr
CH3CH2OH+HBr
| 硫酸 |
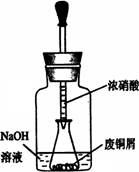
某课外小组欲在实验室制备溴乙烷的装置如图.数据如表.
| 物质 数据 |
乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g?cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
(1)加入药品之前须做的操作是:
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了
(5)粗产品中含有的主要有机液体杂质是
| |||||||||||
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr CH3CH2Br
+ H2O
CH3CH2Br
+ H2O
某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。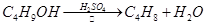
|
物质 数据 |
乙醇 |
溴乙烷 |
1,2-二溴乙烷 |
乙醚 |
浓硫酸 |
|
密度/g·cm-3 |
0.79 |
1.46 |
2.2 |
0.71 |
1.84 |
|
熔点(℃) |
-130 |
-119 |
9 |
-116 |
10 |
|
沸点(℃) |
78.5 |
38.4 |
132 |
34.6 |
338 |
|
在水中的溶解度(g/100g水) |
互溶 |
0.914 |
1 |
7.5 |
互溶 |
请回答下列问题。
(1)加入药品之前须做的操作是:_________________,实验进行的途中若发现未加入碎瓷片,其处理的方法是__________________。
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是_____________。温度计的温度应控制在_____________之间。
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是___________,______________,此操作可在___________(填写玻璃仪器名称)中进行,同时进行分离。
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了_______________________。
(5)粗产品中含有的主要有机液体杂质是_____________,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______________操作。
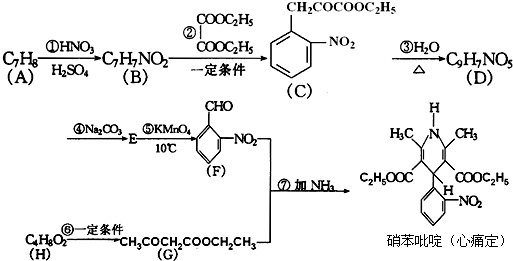
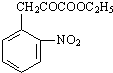 +H2O
+H2O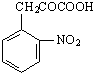 +C2H5OH
+C2H5OH