题目内容
下列说法正确的是
| A.原子的第一电离能越大,该元素的电负性就越大 |
| B.原子的电子层数越多,原子半径越大 |
| C.原子失去电子越多,说明其还原性越强 |
| D.同一原子的能层越高,S电子云的半径越大 |
D
解析试题分析:A、这两者没直接关系,电离能是气态原子测出来的,电负性是从共价化合物中测出来的,一般第一电离能越大的电负性越大,但第二主族跟第三主族、第五主族跟第六主族比较特殊,如Mg的第一电离能大于Al,电负性却小于Al,错误;B、碱金属元素钠的半径就比钾的半径大,错误;C、原子失去电子越容易,其单质还原性越强,而不是原子失去电子越多,例如铝在反应中失去3个电子而钠在反应中失去1个电子,但是钠的还原性比铝强,错误;
考点:考察电离能、电负性、原子半径比较等知识。

练习册系列答案
相关题目
元素的原子结构决定其性质和在周期表中的位置,下列说法正确的是
| A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
B.某微粒的结构示意简图为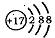 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 |
| C.Be(OH)2的碱性比Mg(OH)2的碱性强 |
| D.原子半径:Na>Si>O |
下列说法正确的是
A.H与D,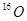 与 与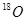 互为同位素: 互为同位素: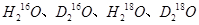 互为同素异形体 互为同素异形体 |
| B.元素X含氧酸的酸性强于元素Y的含氧酸的酸性,则X的得电子能力强于元素Y |
| C.质量数相同的不同核素,一定属于不同种元素 |
D.常温下,在pH=1的溶液中,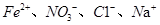 能够大量共存 能够大量共存 |
下列叙述与对应图式正确的是
A.由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强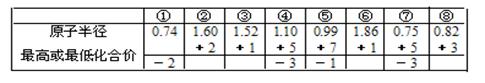 |
B.图甲表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2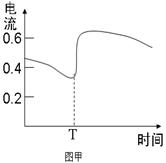  |
| C.图乙表示某一放热反应,若使用催化剂E1、E2、ΔH都会发生改变 |
| D.表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H= -571.6kJ/mol |
下表为六种短周期元素的部分性质。
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.37 | 0.74 | 0.75 | 0.82 | 0.99 | 1.10 |
| 主要化合价 | +1 | -2 | +5、-3 | +3 | +7、-1 | +5、-3 |
下列有关说法正确的是
A.元素X、Y、Z形成的化合物一定是离子化合物
B.元素R的氧化物对应水化物一定为强酸
C.化合物QR3分子中各原子均满足8电子稳定结构
D.元素Z的简单气态氢化物的热稳定性比元素T的稳定
下图为短周期的一部分,Y原子最外层电子数是其电子层数的2倍,下列说法正确的是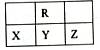
| A.Y的氢化物比Z的氢化物稳定 |
| B.原子半径大小顺序是X >Y>R |
| C.Y、R形成的化台物YR2能使酸性KMnO4溶液褪色 |
| D.四种元素中最高价氧化物的水化物的酸性最强的是Y |