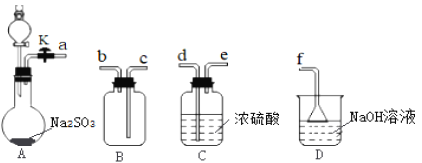
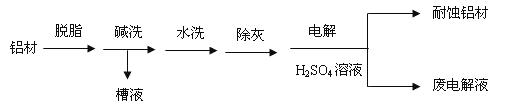
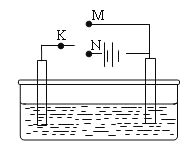
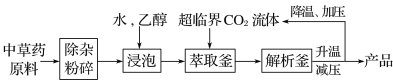
题目内容
【题目】如下图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。下列说法正确的是

A.甲室的质量为32.8g或11g
B.甲室气体的体积为22.4L
C.甲室中NH3和H2的物质的量之比为2:3
D.抽开隔板a,已知NH3+HCl=NH4Cl(固体),隔板b最终停在3处
【答案】B
【解析】
A. 在乙室中HCl气体的物质的质量是0.6mol×36.5g/mol=21.9g,因为单位体积的NH3或H2的质量都比HCl小,所以混合气体的质量也比HCl少。则混合气体的质量是21.9g-10.9g=11.0g,故A错误;
B. 在同温同压下,气体的体积比等于它们的物质的量的比,n(混合):n(HCl)=5:3;由于n(HCl)=0.6mol,则n(混合):0.6=5:3;n(混合)=1mol,标准状况下,体积为22.4L,故B正确;
C. 假设混合气体NH3、H2的物质的量分别是x、y。则x+y=1,17x+2y=11。解得x=0.6mol;y=0.4mol。所以在甲室中NH3、H2的物质的量之比n(NH3):n(H2)=0.6:0.4=3:2,故C错误;
D. 将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),由于n(HCl)= n(NH3)=0.6mol,当HCl与NH3充分反应后,容器中的HCl和NH3恰好反应得到NH4Cl固体,最后只剩余0.4mol的氢气。由于在同温同压下,气体的体积比等于它们的物质的量的比,所以0.6mol的气体具有3个体积,则0.4mol的气体占据2个体积。因此充分反应后,活塞b将位于刻度“2”处,故D错误;
正确答案是B。

 习题精选系列答案
习题精选系列答案