题目内容
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液加热反应可制取氯气,他们设计如下实验用于制取氯气并验证其性质。
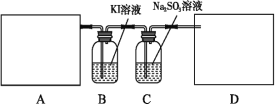
试回答:
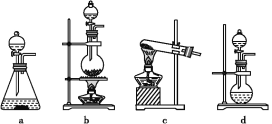
(1)该实验中A部分的装置是___________ (填写字母)。A部分的装置中发生反应的化学方程式为:___________。
(2)B中的发生反应的离子方程式为____________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因:___________。请你帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)__________。
(4)请根据题意画出D处的实验装置图,并注明盛放的物质___________。
【答案】b Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O Cl2+2I-=I2+2Cl- SO32-+Cl2+H2O=SO42-+2Cl-+2H+ 从C中取出少量溶液至小试管中,加入足量的稀盐酸,然后滴加BaCl2溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化
2CaSO4+2Cl2↑+2H2O Cl2+2I-=I2+2Cl- SO32-+Cl2+H2O=SO42-+2Cl-+2H+ 从C中取出少量溶液至小试管中,加入足量的稀盐酸,然后滴加BaCl2溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化 
【解析】
(1)依据反应物状态和反应条件选择发生装置;
(2)氯气与碘化钾反应生成碘单质,碘单质遇到淀粉变蓝;
(3)氯气具有氧化性,亚硫酸钠被氧化会生成硫酸钠,根据硫酸根离子的检验方法检验即可;
(4)氯气有毒,应进行尾气处理。
(1)由查阅资料和方程式可知反应为固体和液体的反应,且在加热的条件下反应,应用装置b制备,反应方程式为:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O;
2CaSO4+2Cl2↑+2H2O;
(2)氯气通入到装置B中发生反应,实验现象为溶液由无色变为黄色或棕褐色,发生反应的离子方程式为Cl2+2I-=I2+2Cl-;
(3)C中亚硫酸钠被氯气氧化生成硫酸钠,反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+,设计实验证明洗气瓶C中的亚硫酸钠已被氧化,即证明有硫酸钠生成,实验操作为从C中取出少量溶液至小试管中,加入足量的稀盐酸,然后滴加BaCl2溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化;
(4)氯气有毒,不能排放到空气中,由于氯气可与碱反应,则可用NaOH溶液进行尾气的吸收,D处的实验装置图可为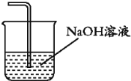 。
。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案