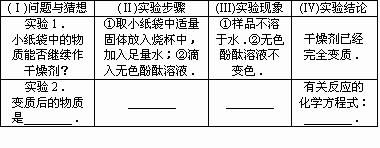
题目内容
(2005·上海)下列离子或原子的电子排布式错误的是
[ ]
A.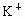
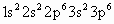
B.F 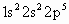
C.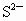
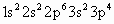
D.Ar 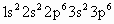
解析:
|
思路分析:根据构造原理和核外电子排布规则可知 B、D选项正确;A项中为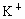 失去最外层的 失去最外层的 电子,而具有稀有气体Ar的电子结构;C项为 电子,而具有稀有气体Ar的电子结构;C项为 ,在S原子的基础上得到2个电子,进入3p轨道从而具有稀有气体Ar的电子结构: ,在S原子的基础上得到2个电子,进入3p轨道从而具有稀有气体Ar的电子结构: ,故C项错误. ,故C项错误.
规律技巧总结:当电中性的原子失去或得到电子变成简单的阳离子或阴离子后,对主族元素来说往往形成具有稀有气体结构的核外电子排布,对副族来说形成阳离子后内层电子可能发生改变,加  的电子排布为 的电子排布为 , ,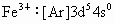 . . |

(2005·上海)(A)
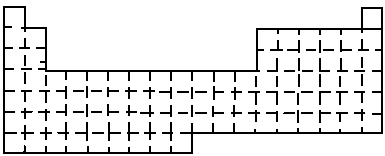
(1)在上面元素周期表中画出金属元素与非金属元素的分界线.
(2)根据NaOH的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的__________族.
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应呈黄色.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲元素与硫元素相比较,非金属性较强的是________(填名称),写出可以验证该结论的一个化学反应方程式_______.
(B)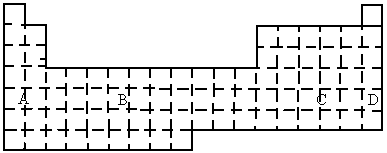
(1)在上面元素周期表中全部是金属元素的区域为_______.
|
a.A |
b.B |
c.C |
d.D |
(2)有人认为形成化合物最多的元素不是ⅣA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是______.
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲、乙两元素相比较,金属性较强的是__________(填名称),可以验证该结论的实验是___________.
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性