题目内容
X、Y、Z、W、Q是原子序数依次增大的5种短5周期主族元素,X、Z同主族,Y、Q同主族,X是周期表中所有元素原子半径最小的,Y是所有元素中非金属性最强的元素,W元素所处周期的序数等于其族序数.下列说法正确的是( )
分析:X、Y、Z、W、Q是原子序数依次增大的5种短5周期主族元素,X是周期表中所有元素原子半径最小的,则X为氢元素,Y是所有元素中非金属性最强的元素,故Y为氟元素;X、Z同主族,Z的原子序数大于氟元素,故Z为Na元素;Y、Q同主族,则Q为Cl元素,W元素原子序数大于钠元素,处于第三周期,所处周期的序数等于其族序数,故W为Al元素,据此解答.
解答:解:X、Y、Z、W、Q是原子序数依次增大的5种短5周期主族元素,X是周期表中所有元素原子半径最小的,则X为氢元素,Y是所有元素中非金属性最强的元素,故Y为氟元素;X、Z同主族,Z的原子序数大于氟元素,故Z为Na元素;Y、Q同主族,则Q为Cl元素,W元素原子序数大于钠元素,处于第三周期,所处周期的序数等于其族序数,故W为Al元素,
A.电子层结构相同核电荷数越大离子半径越小,故离子半径Al3+<Na+<F-,最外层电子数相同电子层越多离子半径越大,故离子半径F-<Cl-,故离子半径Al3+<Na+<F-<Cl-,即W<Z<Y<Q,故A错误;
B.工业上用电解熔融的氧化铝冶炼Al,通常用冰晶石Na3AlF6,降低氧化铝熔点,做助熔剂,故B正确;
C.HF属于共价化合物,只含共价键,NaF属于离子化合物,含有离子键,二者含有化学键类型不同,故C错误;
D.氟气通入NaCl水溶液,与水反应置换出氧气,故D错误;
故选B.
A.电子层结构相同核电荷数越大离子半径越小,故离子半径Al3+<Na+<F-,最外层电子数相同电子层越多离子半径越大,故离子半径F-<Cl-,故离子半径Al3+<Na+<F-<Cl-,即W<Z<Y<Q,故A错误;
B.工业上用电解熔融的氧化铝冶炼Al,通常用冰晶石Na3AlF6,降低氧化铝熔点,做助熔剂,故B正确;
C.HF属于共价化合物,只含共价键,NaF属于离子化合物,含有离子键,二者含有化学键类型不同,故C错误;
D.氟气通入NaCl水溶液,与水反应置换出氧气,故D错误;
故选B.
点评:本题考查结构性质位置关系、半径比较、化学键、化学工业等,难度中等,推断元素的解题的关键,BD选项为易错点,知识点较生疏.

练习册系列答案
相关题目
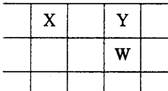 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )| A、五种元素中,原子半径最大的是W | B、Y与Z形成的化合物都可以和盐酸反应 | C、Y的简单阴离子比W的简单阴离子还原性强 | D、Z与Q形成的化合物水溶液一定显酸性 |
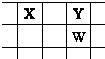 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )| A、五种元素中,原子半径最大的是W | B、Y的简单阴离子比W的简单阴离子还原性强 | C、Y与Z形成的化合物都可以和盐酸反应 | D、Z与Q形成的化合物水溶液一定显酸性 |
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )| A、最高价氧化物对应水化物的酸性最强的是W | B、Y与Z只能形成一种化合物 | C、简单阴离子还原性:Y>W | D、Z与Q形成的化合物水溶液可能显酸性 |