题目内容
【题目】I:一定条件下,在体积为3 L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__________;根据下图,升高温度,K值将__________(填“增大”、“减小”或“不变”)。
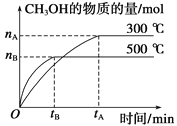
(2)500 ℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是______________(用nB,tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是______(填字母)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(4)300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
II:现有可逆反应.2NO2(g) ![]() N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措施。
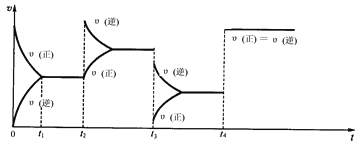
(1)t2:_________________________________________________;
(2)t3:_________________________________________________;
(3)t4:_________________________________________________。
【答案】 ![]() 减小
减小 ![]() mol·L-1·min-1 cd cd 增大生成物N2O4的浓度 降低压强 加入催化剂
mol·L-1·min-1 cd cd 增大生成物N2O4的浓度 降低压强 加入催化剂
【解析】I:(1)根据已知方程式不难得出该反应的平衡常数表达式为:![]() ;根据图像,平衡时500℃下产物甲醇的物质的量小于300℃时的甲醇物质的量,所以随着温度升高平衡逆向移动,说明该反应的K值将减小,该正反应是放热反应△H<0;(2)500℃时,从反应开始到达到化学平衡,反应用时tB 分钟,生成甲醇nB mol,所以反应速率v(H2)=2v(CH3OH)=
;根据图像,平衡时500℃下产物甲醇的物质的量小于300℃时的甲醇物质的量,所以随着温度升高平衡逆向移动,说明该反应的K值将减小,该正反应是放热反应△H<0;(2)500℃时,从反应开始到达到化学平衡,反应用时tB 分钟,生成甲醇nB mol,所以反应速率v(H2)=2v(CH3OH)= ![]() mol·L-1·min-1;(3)反应中各组分的浓度不变时判断可逆反应达到平衡的重要标志,a正确;混合气体密度ρ=m/V,由于参加反应的物质都是气体,质量守恒,混合气体质量始终不变,所以在恒容密闭容器中混合气体密度始终不变,所以不能判断是否达到平衡,b错误;混合气体的平均相对分子质量M= m/n,气体质量不变,但是气体的总物质的量随反应进行而改变,所以M会发生改变,当M不变时,反应达到平衡,c正确;生成甲醇和消耗CO表示的都是正反应速率,所以d项不能判断反应达到平衡;故选ac;(4)压缩容器为原来的1/2,则个物质的浓度均瞬间增大1倍,压强增大,平衡向右移动,虽然平衡向右移动H2浓度减小,但是体积改变使氢气浓度增大影响更大,所以c(H2)增大,a错误;增大压强,正逆反应速率均增大,只是正反应速率增大较多,b错误;平衡右移,甲醇物质的量增大,c正确;重新达到平衡,c(H2)将小于原来浓度的2倍,c(CH3OH)将大于原来浓度的2倍,所以c(H2)/ c(CH3OH)将减小,d正确。故选cd。
mol·L-1·min-1;(3)反应中各组分的浓度不变时判断可逆反应达到平衡的重要标志,a正确;混合气体密度ρ=m/V,由于参加反应的物质都是气体,质量守恒,混合气体质量始终不变,所以在恒容密闭容器中混合气体密度始终不变,所以不能判断是否达到平衡,b错误;混合气体的平均相对分子质量M= m/n,气体质量不变,但是气体的总物质的量随反应进行而改变,所以M会发生改变,当M不变时,反应达到平衡,c正确;生成甲醇和消耗CO表示的都是正反应速率,所以d项不能判断反应达到平衡;故选ac;(4)压缩容器为原来的1/2,则个物质的浓度均瞬间增大1倍,压强增大,平衡向右移动,虽然平衡向右移动H2浓度减小,但是体积改变使氢气浓度增大影响更大,所以c(H2)增大,a错误;增大压强,正逆反应速率均增大,只是正反应速率增大较多,b错误;平衡右移,甲醇物质的量增大,c正确;重新达到平衡,c(H2)将小于原来浓度的2倍,c(CH3OH)将大于原来浓度的2倍,所以c(H2)/ c(CH3OH)将减小,d正确。故选cd。
II: 由图知t2时刻,V(正)不变,V(逆)增大,表明增大生成物的浓度,即增大生成物N2O4的浓度;t2时刻,V(正)、V(逆)均减小,但V(正)<V(逆),表明反应速率减小,平衡逆向移动,可以是降低压强;t4时刻V(正)、V(逆)同等程度的增大,说明使用催化剂。