题目内容
【题目】某兴趣小组的同学设计实验制备并探究SO2的性质。回答下列问题:
(1)实验室用废铜屑制备SO2的化学方程式为______。
(2)将SO2通入NaHS溶液,溶液中有淡黄色沉淀,说明SO2具有______性。
(3)将SO2通过品红溶液,溶液红色逐渐褪去,将褪色后的溶液微热,又显浅红色,这现象可解释为______。
(4)将SO2通入橙黄色酸性K2Cr2O7溶液,溶液逐渐变为浅绿色,该反应中氧化剂与还原剂的物质的量之比为______。(Cr2O72-被还原为Cr3+)
(5)常温下,改变0.1molL-1H2SO3溶液(SO2水溶液)的pH,溶液中的H2SO3、HSO3-、SO32-的物质的量分数δ(X)[δ(X)= 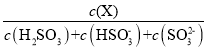 ]随pH的变化如图所示:
]随pH的变化如图所示:
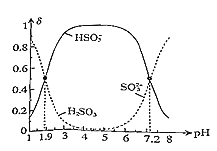
H2SO3的lgKa1=______;反应HSO3-+OH-![]() SO32-+H2O的lgK=______;用0.100molL-1NaOH溶液滴入0.100molL-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,发生的主要反应的离子方程式为______。
SO32-+H2O的lgK=______;用0.100molL-1NaOH溶液滴入0.100molL-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,发生的主要反应的离子方程式为______。
【答案】Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 氧化 二氧化硫具有漂白性,漂白性具有可逆性和不稳定性 1:3 -1.9 6.8 H2SO3+OH-=HSO3-+H2O
CuSO4+SO2↑+2H2O 氧化 二氧化硫具有漂白性,漂白性具有可逆性和不稳定性 1:3 -1.9 6.8 H2SO3+OH-=HSO3-+H2O
【解析】
(1)实验室制二氧化硫,常用铜和浓硫酸在加热时反应。
(2)将SO2通入NaHS溶液,溶液中生成淡黄色沉淀S,二氧化硫中硫元素化合价由+4价降低到0价。
(3)生成的二氧化硫使品红溶液逐渐褪色,说明二氧化硫具有漂白性,漂白性不稳定。
(4)将SO2通入橙黄色酸性K2Cr2O7溶液,溶液逐渐变为浅绿色,Cr2O72-被还原为Cr3+,依据电子守恒,计算该反应中氧化剂与还原剂的物质的量之比。
(5)H2SO3的lgKa1=lg![]() ,当c(HSO3-)=c(H2SO3)时,pH=1.9,反应HSO3-+OH-
,当c(HSO3-)=c(H2SO3)时,pH=1.9,反应HSO3-+OH-![]() SO32-+H2O的lgK=lg
SO32-+H2O的lgK=lg![]() , 当c(HSO3-)=c(SO32-)时,pH=7.2,据此计算。用0.100molL-1NaOH溶液滴入0.100molL-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,溶液显酸性,生成亚硫酸氢钠。
, 当c(HSO3-)=c(SO32-)时,pH=7.2,据此计算。用0.100molL-1NaOH溶液滴入0.100molL-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,溶液显酸性,生成亚硫酸氢钠。
(1)铜和浓硫酸加热反应生成二氧化硫气体,反应的化学方程式:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O。答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)将SO2通入NaHS溶液,溶液中生成淡黄色沉淀S,二氧化硫中硫元素化合价由+4价降低到0价,作氧化剂,具有氧化性。答案为:氧化;
(3)将SO2通过品红溶液,溶液红色逐渐褪去,将褪色后的溶液微热,又显浅红色,这现象可解释为:二氧化硫具有漂白性,漂白性具有可逆性和不稳定性。答案为:二氧化硫具有漂白性,漂白性具有可逆性和不稳定性;
(4)将SO2通入橙黄色酸性K2Cr2O7溶液,溶液逐渐变为浅绿色,Cr2O72-被还原为Cr3+,结合电子守恒,可得反应方程式为:3SO2+2H++Cr2O72-=3SO42-+H2O+2Cr3+,该反应中氧化剂与还原剂的物质的量之比1:3。答案为:1:3;
(5) H2SO3的lgKa1=lg![]() ,当c(HSO3-)=c(H2SO3)时,pH=1.9,c(H+)=10-1.9mol/L,lgKa1=lgc(H+)=-1.9;反应HSO3-+OH-
,当c(HSO3-)=c(H2SO3)时,pH=1.9,c(H+)=10-1.9mol/L,lgKa1=lgc(H+)=-1.9;反应HSO3-+OH-![]() SO32-+H2O的lgK=lg
SO32-+H2O的lgK=lg![]() , 当c(HSO3-)=c(SO32-)时,pH=7.2,c(H+)=10-7.2mol/L,lgK=lg
, 当c(HSO3-)=c(SO32-)时,pH=7.2,c(H+)=10-7.2mol/L,lgK=lg![]() = lg
= lg![]() =6.8。
=6.8。
用0.100molL-1NaOH溶液滴入0.100molL-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,溶液显酸性,生成亚硫酸氢钠,反应的离子方程式为:H2SO3+OH-=HSO3-+H2O。答案为:-1.9;6.8;H2SO3+OH-=HSO3-+H2O。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案