题目内容
X、Y、Z、W是原子序数依次增大的短周期主族元素,X与Z同主族,X原子的最外层电子数是其最内层电子数的2倍,Y原子的最外层电子数比W原子的少2个。下列叙述一定正确的是
| A.X、Y的单质均可以导电 |
| B.原子半径:Z>W |
| C.X、Z的氧化物均为酸性氧化物 |
| D.Y、W的最高价氧化物的水化物均易溶于水 |
B
解析试题分析: X最外层电子数是内层电子数的2倍可推出X为C,X与Z同主族可推出Z为Si,W比Y多2个电子,可推出W为P、Y为Al。
A、铝能导电、碳元素形成的单质石墨可以导电,金刚石和C60不能导电,错误;B、同周期从左向右,原子半径减小,原子半径:Si>P,正确;C、二氧化硅、二氧化碳是酸性氧化物,CO是不成盐氧化物,错误;D、氢氧化铝和硅酸均不溶于水,错误。
考点: 元素周期表和元素周期律 酸性氧化物

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
元素的原子结构决定其性质和在周期表中的位置。下列叙述正确的是
| A.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| B.原子核外电子的数目越多,电子的运动状态就越多 |
| C.轨道表示式,是对原子核外电子运动状态最完美的描述 |
| D.所有元素原子的最外层电子数都等于该元素的最高化合价 |
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是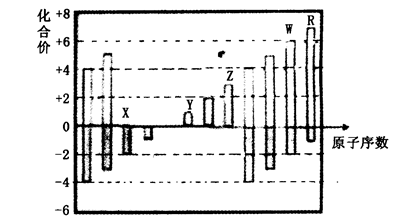
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R<W |
| C.WX3和水反应生成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
短周期元素T、X、Y、Z的原子序数依次增大,T与Z属于同一主族,X、Y、Z最高价氧化物对应的水化物两两之间都能反应,且X、Y、Z原子最外层电子数之和等于X的原子序数。则下列说法正确的是
| A.简单离子半径大小顺序:rT>rX>rY |
| B.T与Z的最高正化合价相等 |
| C.室温下,单质Y不能与浓硫酸反应 |
| D.用电解法可制得T、X、Y的单质 |
氧元素是地壳中含量最多的元素。下列说法正确的是
| A.16O2与18O3互为同位素 |
| B.氧元素与其它短周期非金属元素形成的氧化物均属于酸性氧化物 |
| C.O2变成O3以及16O变成18O的变化均属于化学变化 |
| D.氧与钠形成的稳定化合物中,阴、阳离子个数比均为1∶2 |
下列说法正确的是
A.H与D,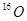 与 与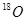 互为同位素: 互为同位素: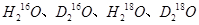 互为同素异形体 互为同素异形体 |
| B.元素X含氧酸的酸性强于元素Y的含氧酸的酸性,则X的得电子能力强于元素Y |
| C.质量数相同的不同核素,一定属于不同种元素 |
D.常温下,在pH=1的溶液中,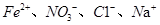 能够大量共存 能够大量共存 |
短周期元素X、Y、Z中,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1个,下列比较正确的是
| A.原子半径:X>Y | B.元素非金属性:X>Y |
| C.气态氢化物的稳定性:Z>Y | D.最高价氧化物水化物的酸性:Z>Y |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和ⅡA族,碱性:CsOH >Ba(OH)2 |