题目内容
【题目】下面是实验室制取氨气及氨气还原氧化铜实验。
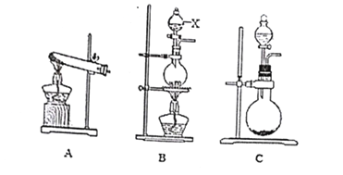
(1)实验用氢氧化钙与氯化铵制取氨气,其化学方程式为____________________________,应选用___(填序号)作为气体发生装置。B装置中仪器X的名称为______________。
(2)氨气与氧化铜反应原理为:3CuO+2NH3![]() 3Cu+N2+3H2O.实验小组利用如下图所示装置,检验纯氨气于氧化铜反应的部分产物。
3Cu+N2+3H2O.实验小组利用如下图所示装置,检验纯氨气于氧化铜反应的部分产物。
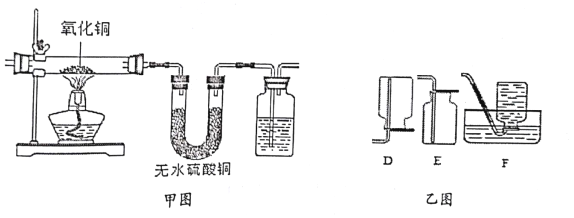
①甲图实验可以看到的实验现象是___________________________
②收集产物氮气时,选用乙图中的装置_________(填序号)
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O A 分液漏斗 黑色固体变为红色,U形管中白色固体变为蓝色,洗气瓶中导管口有气泡冒出 F
CaCl2+2NH3↑+2H2O A 分液漏斗 黑色固体变为红色,U形管中白色固体变为蓝色,洗气瓶中导管口有气泡冒出 F
【解析】
(1)实验室中通常是用氯化铵和氢氧化钙加热反应制取氨气的,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。由题意可知实验室制取氨气的发生装置为“固体加热型”,应选择装置A作为气体发生装置,B装置中仪器X的名称为分液漏斗,
CaCl2+2NH3↑+2H2O。由题意可知实验室制取氨气的发生装置为“固体加热型”,应选择装置A作为气体发生装置,B装置中仪器X的名称为分液漏斗,
故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,A,分液漏斗。
CaCl2+2NH3↑+2H2O,A,分液漏斗。
(2)①氨气与铜发生反应产生氮气、铜单质及水,可以通过甲图中试管中的固体由黑色变为红色,U形管中白色的无水硫酸铜变为蓝色的晶体以及洗气瓶中导管口有气泡冒出来确定反应的生成物,故答案为:黑色固体变为红色,U形管中白色固体变为蓝色,洗气瓶中导管口有气泡冒出。
②氮气的密度与空气的密度相当,不能使用排空气法收集,可以采用排水法收集,选用乙图中的装置F来收集氮气,故答案为:F。

练习册系列答案
相关题目