��Ŀ����
����β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����塣
��1������β����CO��NO2������һ�������¿��Է�����Ӧ��
4CO(g)+2NO2(g) 4CO2(g)+N2(g)����H=��1200 kJ��mol��1
4CO2(g)+N2(g)����H=��1200 kJ��mol��1
�ٺ��º��������£�����˵���÷�Ӧ�Ѵﵽƽ��״̬����________(�����)��
A�������ڻ��������ɫ���ٱ仯 B�������ڵ�ѹǿ���ֲ���
C��2v��(NO2)=v��(N2) D�������ڻ�������ܶȱ��ֲ���
����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ�����淴Ӧ�����ƶ�����________(�����)��
A����ʱ�����CO2 B���ʵ������¶�
C����С�������ʹ��ϵѹǿ���� D��ѡ���Ч����
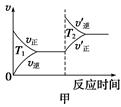
�۶��ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����________(�����)��
��2������β����CO��H2O(g)��һ�������¿��Է�����Ӧ��CO(g)+H2O(g) CO2(g)+H2(g) ��H<0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����ұ�����Ͷ�ϣ��ﵽƽ��״̬ʱK=1.0��
CO2(g)+H2(g) ��H<0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����ұ�����Ͷ�ϣ��ﵽƽ��״̬ʱK=1.0��
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ___________��ƽ��ʱ����������CO��ת����= ��
��ƽ��ʱ���Ƚ�����������CO��ת���ʣ��� ��(�>������=����<������ͬ)���� �ס�
��1������β����CO��NO2������һ�������¿��Է�����Ӧ��
4CO(g)+2NO2(g)
 4CO2(g)+N2(g)����H=��1200 kJ��mol��1
4CO2(g)+N2(g)����H=��1200 kJ��mol��1�ٺ��º��������£�����˵���÷�Ӧ�Ѵﵽƽ��״̬����________(�����)��
A�������ڻ��������ɫ���ٱ仯 B�������ڵ�ѹǿ���ֲ���
C��2v��(NO2)=v��(N2) D�������ڻ�������ܶȱ��ֲ���
����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ�����淴Ӧ�����ƶ�����________(�����)��
A����ʱ�����CO2 B���ʵ������¶�
C����С�������ʹ��ϵѹǿ���� D��ѡ���Ч����
�۶��ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����________(�����)��


��2������β����CO��H2O(g)��һ�������¿��Է�����Ӧ��CO(g)+H2O(g)
 CO2(g)+H2(g) ��H<0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����ұ�����Ͷ�ϣ��ﵽƽ��״̬ʱK=1.0��
CO2(g)+H2(g) ��H<0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����ұ�����Ͷ�ϣ��ﵽƽ��״̬ʱK=1.0��| ��ʼ���ʵ��� | �� | �� | �� |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ___________��ƽ��ʱ����������CO��ת����= ��
��ƽ��ʱ���Ƚ�����������CO��ת���ʣ��� ��(�>������=����<������ͬ)���� �ס�
��15�֣�
��1�� �� C D�� �� B �� �ң���2�֣�
��2�� ��K=" c" (CO2)��c (H2)��[c (CO)��c (H2O)]��2�֣� 50% ��3�֣�
�ڡ�> = ����2�֣���
��1�� �� C D�� �� B �� �ң���2�֣�
��2�� ��K=" c" (CO2)��c (H2)��[c (CO)��c (H2O)]��2�֣� 50% ��3�֣�
�ڡ�> = ����2�֣���
�����������1���ٷ�Ӧ��ϵ��ֻ�ж��������Ǻ���ɫ���壬�����Ϊ��ɫ���壬������������ɫ���ٱ仯��˵����������Ũ�Ȳ��ٱ仯������Ӧ�ﵽƽ�⣬��A��������Ӧ������У���������Ӧ���������ʵ�����С�ķ�Ӧ����������ڻ�������ѹǿ��С����ѹǿ���ֲ��䣬˵������ֵ����ʵ������ֲ��䣬����Ӧ�ﵽƽ�⣬��B����ͬһ���ʱ�ʾ��v��= v������ͬ���ʱ�ʾ�淴Ӧ���ʺ�����Ӧ����֮�ȵ��ڻ�ѧ����ʽ�ж�Ӧϵ��֮�ȣ�����˵����Ӧ�ﵽƽ�⣬��v��(NO2)/v��(N2)=2/1������v��(NO2)=2v��(N2)��˵����Ӧ�ﵽƽ�⣬��2v��(NO2)=v��(N2)����˵����Ӧ�ﵽƽ�⣬��C��ȷ�����������ܶȵ������������������ݻ������ڷ�Ӧ��������ﶼ�����壬��Ӧ��ѭ�����غ㶨�ɣ���������������ʼ�ղ��䣬����������������䣬����������ܶ�ʼ�ղ���ı䣬����ܶȲ��䲻��˵����Ӧ�ﵽƽ�⣬��D��ȷ���ڼ�ʱ�����������̼������С������Ũ�ȣ���Ӧ���ʼ�С��ƽ��������Ӧ�����ƶ�����A����H=��1200 kJ��mol��1��������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ���Ӧ��������ƽ�������ȷ�Ӧ���淴Ӧ�����ƶ�����B��ȷ������Ӧ�����������С�ķ���С�����������ѹǿ������Ӧ���������Ũ�ȣ���Ӧ��������ƽ�������������С������Ӧ�����ƶ�����C����ѡ���Ч������������Ӧ���ʣ����Ƕ�ƽ����Ӱ�죬ƽ�ⲻ�ƶ�����D����ƽ��ʱ�����¶ȣ����淴Ӧ���ʶ���ͻȻ���������ȷ�Ӧ�������������̶ȴ��ڷ��ȷ�Ӧ��������ʣ����淴Ӧ����>����Ӧ����>ԭƽ��ʱ�����淴Ӧ����=ԭƽ��ʱ���淴Ӧ���ʣ��ʼ�ͼ���������¶ȣ���Ӧ���ʼӿ죬ƽ�����淴Ӧ�����ƶ����������̴ﵽƽ���ʱ�䣬����ʹ��Ӧ���ƽ��ת���ʼ�С����T2ʱ���߱�T1ʱ�ȴﵽƽ�⣬ƽ��ʱ����������ת���ʽ��ͣ�����ͼ��ȷ������ѹǿ��ƽ��������Ӧ�����ƶ�����Ӧ������ʵ�����С����һ����̼�����������С���������������¶ȣ�ƽ�����淴Ӧ�����ƶ�����Ӧ������ʵ���������һ����̼��������������Ǽ�С���ʱ�ͼ����2����ƽ�ⳣ������ƽ��ʱ������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ����CO(g)+H2O(g)
 CO2(g)+H2(g)��ƽ�ⳣ��K�ı���ʽΪ
CO2(g)+H2(g)��ƽ�ⳣ��K�ı���ʽΪ �����������ݻ�δ֪��Ϊ�˼�������̣������ݻ�Ϊ1L����������CO�ı仯Ũ��Ϊx mol��L��1������÷�Ӧ�и���ֵģ���ʼ���仯��ƽ�⣩Ũ�ȣ���
�����������ݻ�δ֪��Ϊ�˼�������̣������ݻ�Ϊ1L����������CO�ı仯Ũ��Ϊx mol��L��1������÷�Ӧ�и���ֵģ���ʼ���仯��ƽ�⣩Ũ�ȣ���CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)��ʼŨ��/mol��L��1 0.10 0.10 0 0
�仯Ũ��/mol��L��1 x x x x
ƽ��Ũ��/mol��L��1 0.10��x 0.10��x x x
K=
 =
= =1.0
=1.0��ã�x =0.050
��1���ס��ң���������ˮ������Ũ�ȣ�����һ�ַ�Ӧ��Ũ�ȣ�ƽ��������Ӧ�����ƶ�����һ�ַ�Ӧ���ת����������һ����̼��ƽ��ת���ʣ���<�ң�����ͨ������Ƚϣ���
�����ݻ�Ϊ1L����������CO�ı仯Ũ��Ϊy mol��L��1������÷�Ӧ�и���ֵģ���ʼ���仯��ƽ�⣩Ũ�ȣ���
CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)��ʼŨ��/mol��L��1 0.10 0.20 0 0
�仯Ũ��/mol��L��1 y y y y
ƽ��Ũ��/mol��L��1 0.10��y 0.20��y y y
K=
 =
= =1.0
=1.0��ã�y =0.20/3
��ƽ��ʱ��������һ����̼��ƽ��ת����Ϊ��
 ��100%=
��100%= ��100%=67%>50%��
��100%=67%>50%��2���ס�������ʼͶ�ϼӱ���Ͷ�ϱȲ��䣬�����������ַ�Ӧ��Ũ������ѹǿ����������Ӧ�������������ķ�Ӧ����ƽ�ⲻ�ƶ���һ����̼ƽ��ת���ʱ��ֲ��䣬��һ����̼��ƽ��ת���ʣ���=��������ͨ������Ƚϣ���
�����ݻ�Ϊ1L����������CO�ı仯Ũ��Ϊz mol��L��1������÷�Ӧ�и���ֵģ���ʼ���仯��ƽ�⣩Ũ�ȣ���
CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)��ʼŨ��/mol��L��1 0.20 0.20 0 0
�仯Ũ��/mol��L��1 z z z z
ƽ��Ũ��/mol��L��1 0.20��z 0.20��z z z
K=
 =
= =1.0
=1.0��ã�z =0.10
��ƽ��ʱ��������һ����̼��ƽ��ת����Ϊ��
 ��100%=
��100%= ��100%=50%��
��100%=50%��
��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
 CO(g) + H2O(g) ��H1����41.2kJ��moL��1��
CO(g) + H2O(g) ��H1����41.2kJ��moL��1�� 2NH3(g) ��2 minʱ�ﵽƽ��״̬����ʱc(N2)��5.00 mol/L��c(H2)��10.00mol/L��c(NH3)��5.00 mol/L������д��������̣�
2NH3(g) ��2 minʱ�ﵽƽ��״̬����ʱc(N2)��5.00 mol/L��c(H2)��10.00mol/L��c(NH3)��5.00 mol/L������д��������̣� ?2AB3��Ӧ��˵�����·�Ӧ���ʱ�ʾ��Ӧ�����ǣ� ��
?2AB3��Ӧ��˵�����·�Ӧ���ʱ�ʾ��Ӧ�����ǣ� �� 2C��g��+D��g������ij��ʱ���ڣ���A��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ2 mol/��L��s��������C��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ
2C��g��+D��g������ij��ʱ���ڣ���A��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ2 mol/��L��s��������C��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���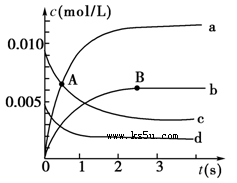
 ��n=
��n=