题目内容
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol·L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是 ( )
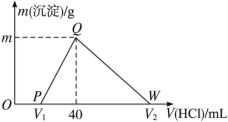
A.原合金质量为0.92 g B.图中V2为100
C.沉淀的质量m为1.56 g D.OP段发生的反应为:OH-+H+=== H2O
【答案】A
【解析】
试题分析:(1)2Na+2H2O=2NaOH+H2↑,2Al+2OH-+2H2O=2AlO2-+3H2↑,反应后pH=14,说明生成NaOH过量,此时n(OH-)=20×10-3×1mol=0.02mol,因此0~V1段发生的反应是H++OH-=H2O,此段消耗的盐酸的体积为0.02×103/1mL=20mL,PQ段发生反应是AlO2-+H++H2O=Al(OH)3↓,Q点溶质为NaCl,根据元素守恒,n(Na)=n(NaCl)=n(HCl)=40×10-3×1mol=0.04mol,合金与水反应后溶质为NaOH和NaAlO2,根据n(NaOH)=n(OH-)=0.02mol,根据Na元素守恒n(NaAlO2)=n(Na)-n(NaOH)=(0.04-0.02)mol=0.02mol,因此n(Al)=0.02mol,合金的质量为(0.04×23+0.02×27)g=1.46g,故说法错误;(2)QW段发生Al(OH)3+3H+=Al3++3H2O,消耗的n(H+)=3×n(Al)=3×0.02mol=0.06mol,即此段消耗盐酸的体积为0.06×1000/1mL=60mL,V2=100mL,故说法正确;C、沉淀是Al(OH)3,其质量为0.02×78g=1.56g,故说法正确;D、根据选项A的分析,故说法正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案