题目内容
【题目】某学生化学课外兴趣小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,进行了下列实验探究。
【提出假设】
假设1:沉淀为CuCO3;
假设2:沉淀为 ;
假设3:沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2·mCuCO3]。
【查阅资料】这三种沉淀受热均易分解,都生成黑色固体CuO。
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如下装置(夹持仪器未画)进行定性实验;
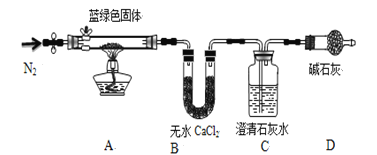
【问题讨论】
(1)假设2中的沉淀为 ,提出该假设的理论依据是 ,
(2)步骤1用无水乙醇洗涤,再风干的目的 ,
(3)装置D装有碱石灰的干燥管所起的作用是 ,
(4)若反应后A中蓝绿色固体变黑,C中澄清石灰水变浑浊,证明假设 (填写序号)一定不成立
(5)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,通过观察便可验证上述所有假设,该试剂是 (填代号)
A.浓硫酸 B.无水CuSO4 C.碱石灰 d.P2O5
(6)该小组经试验确定假设3成立,他们想进一步测定蓝绿色固体的化学式,丙同学查得一些物质在20℃的数据(如下表)后,建议将C中的澄清石灰水改为Ba(OH)2溶液,其原因是 (双选,填代号)
溶解度(s)/g | 溶度积(Ksp) | 摩尔质量(M)g/mol | |||
Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
a.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
(7)作上述调整后,若所取蓝绿色固体质量为27.1g,实验结束后装置B中无水氯化钙的质量增加2.7g,C中氢氧化钡溶液里产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 ,
【答案】
(1)Cu(OH)2;碳酸根水解,溶液中含有较多的OH—
(2)利用乙醇的易挥发,带走洗涤的水
(3)防止外界空气中的二氧化碳及水蒸气加入C中,影响实验结果
(4)假设2;(5)b;(6)a c
(7)2 CuCO33Cu(OH)2或3Cu(OH)22 CuCO3或Cu5 (OH)6(CO3)2
【解析】
试题分析:(1)CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,可能是反应生成了碳酸铜沉淀,或双水解生成了氢氧化铜沉淀,或是碱式碳酸铜,因此假设1中沉淀为CuCO3,假设2为,Cu(OH)2;故答案为:Cu(OH)2;碳酸根水解,溶液中含有较多的OH—;
(2)步骤1用无水乙醇洗涤,乙醇的易挥发,风干时容易带走洗涤的水,故答案为:利用乙醇的易挥发,带走洗涤的水;
(3)装置D装有碱石灰的干燥管可以防止外界空气中的二氧化碳及水蒸气加入C中,影响实验结果,故答案为:防止外界空气中的二氧化碳及水蒸气加入C中,影响实验结果;
(4)若反应后A中蓝绿色固体变黑,C中澄清石灰水变浑浊,证明生成了二氧化碳气体,证明假设2一定不成立,故答案为:假设2;
(5)实验验证碳酸铜或氢氧化铜是利用受热分解生成的产物性质验证,加热时,碳酸铜分解生成二氧化碳和黑色氧化铜,加热氢氧化铜时生成水蒸气和黑色氧化铜,所以需要验证水的存在和二氧化碳的存在就可以证明产生的物质成分,装置A中加热是否变化为黑色固体,装置B选择无水硫酸铜验证是否生成水,澄清石灰水是否变浑浊证明是否生成二氧化碳,所以要将上图中B装置的试剂改用无水CuSO4,故选b;
(6)①Ba(OH)2溶解度大于Ca(OH)2,充分吸收CO2,BaCO3的摩尔质量大于CaCO3,测量误差小;氢氧化钙为强碱,CaCO3的溶解度和BaCO3溶解度相差不大,故答案为:ac;
(7)B中吸收的是水,水的物质的量=![]() =0.15mol,C中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量=
=0.15mol,C中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量=![]() =0.1mol,氧化铜的物质的量=
=0.1mol,氧化铜的物质的量=![]() =0.25mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25mol:0.3mol:0.1mol=5:6:2,所以其化学式为:2 CuCO33Cu(OH)2 或 3Cu(OH)22 CuCO3 或 Cu5(OH)6(CO3)2,故答案为:2 CuCO33Cu(OH)2 或 3Cu(OH)22 CuCO3 或 Cu5(OH)6(CO3)2。
=0.25mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25mol:0.3mol:0.1mol=5:6:2,所以其化学式为:2 CuCO33Cu(OH)2 或 3Cu(OH)22 CuCO3 或 Cu5(OH)6(CO3)2,故答案为:2 CuCO33Cu(OH)2 或 3Cu(OH)22 CuCO3 或 Cu5(OH)6(CO3)2。