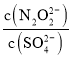题目内容
【题目】最近,著名记者柴静的雾霾调查纪录片![]() 穹顶之下
穹顶之下![]() ,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法.
,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法.
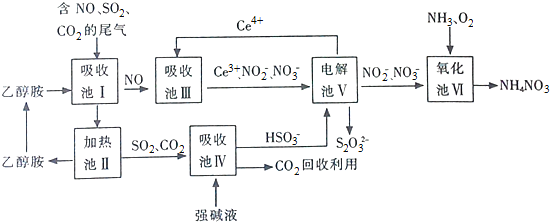
(1)上述流程中循环使用的物质有 ______ ,吸收池Ⅰ吸收的气体有 ______ .
(2)向吸收池Ⅳ得到的![]() 溶液中滴加
溶液中滴加![]() 溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: ______ .
溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: ______ .
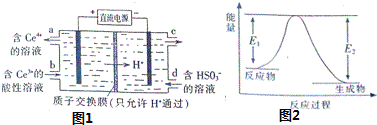
(3)电解池Ⅴ制得![]() 的原理如图1所示.
的原理如图1所示.
写出电解总反应的离子方程式 ______ .
(4)![]() 和
和![]() 反应生成
反应生成![]() 和
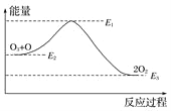
和![]() ,反应过程中的能量变化如图2,
,反应过程中的能量变化如图2,![]() ,
,![]() .
.
已知:①![]()
②![]()
请写出NO与CO反应生成无污染气体的热化学方程式: ______ .
(5)上述流程中每一步均恰好完全反应,若制得![]() 质量为xkg,电解池V制得
质量为xkg,电解池V制得![]() 的
的![]() 溶液
溶液![]() ,则氧化池Ⅵ中消耗的
,则氧化池Ⅵ中消耗的![]() 在标准状况下的体积为 ______
在标准状况下的体积为 ______ ![]() .
.
【答案】乙醇胺、![]()
![]() 、
、![]()
![]() 溶液中存在电离平衡:
溶液中存在电离平衡:![]() ,加入氯化钙以后,钙离子会消耗硫酸根离子产生硫酸钙沉淀,导致电离平衡正向移动,氢离子浓度增大,所以溶液pH降低
,加入氯化钙以后,钙离子会消耗硫酸根离子产生硫酸钙沉淀,导致电离平衡正向移动,氢离子浓度增大,所以溶液pH降低 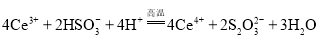
![]() 0.21x-22.4cy
0.21x-22.4cy
【解析】
(1)根据流程图中物质的循环来判断循环使用的物质;根据吸收池Ⅰ进入的气体NO、CO2、SO2结合出来的气体是NO,来确定吸收的气体;
(2)亚硫酸氢根离子存在电离平衡,加入氯化钙,钙离子会影响化学平衡的移动,根据平衡移动原理来解释;
(3)根据电解池的工作原理:阳极上是Ce3+失电子的氧化反应,阴极上是HSO3得电子的还原反应,据此书写电解原理方程式;
(4)已知①![]()
②![]()
298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO的热化学方程式为③2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=(368134)kJ/mol=234kJ/mol,
由盖斯定律(②①+③)÷2得到反应的热化学方程式:2NO(g)+2CO(g)N2(g)+2CO2(g),根据盖斯定律计算焓变;
(5)根据N元素守恒,找到硝酸根离子、亚硝酸根离子以及硝酸铵之间的关系,根据电子守恒,得到Ce3+、Ce4+、S2O32之间的关系,进行计算即可。
(1)根据流程图中物质的循环,得到循环使用的物质是乙醇胺、Ce4+;根据吸收池Ⅰ进入的气体NO、CO2、SO2,出来的气体是NO,确定吸收的气体是CO2、SO2;故答案为:乙醇胺、Ce4+;CO2、SO2;
(2)HSO3溶液中存在电离平衡:HSO3H++SO32,加入氯化钙以后,钙离子会消耗硫酸根离子产生硫酸钙沉淀,导致电离平衡正向移动,氢离子浓度增大,所以溶液pH降低;故答案为:![]() 溶液中存在电离平衡:
溶液中存在电离平衡:![]() ,加入氯化钙以后,钙离子会消耗硫酸根离子产生硫酸钙沉淀,导致电离平衡正向移动,氢离子浓度增大,所以溶液pH降低;
,加入氯化钙以后,钙离子会消耗硫酸根离子产生硫酸钙沉淀,导致电离平衡正向移动,氢离子浓度增大,所以溶液pH降低;
(3)根据电解池的工作原理:阳极上是Ce3+失电子的氧化反应,阴极上是HSO3得电子的还原反应,电解原理方程式为: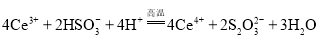 ;故答案为:
;故答案为: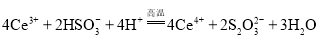 ;
;
(4) 已知①![]()
②![]()
298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO的热化学方程式为③2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=(
由盖斯定律(②①+③)÷2得到反应的热化学方程式:![]() ,故答案为:
,故答案为:![]() ;
;
(5)设亚硝酸根离子、硝酸根离子的物质的量分别是m、n,从Ⅴ→Ⅵ→硝酸铵,根据N元素守恒,得到①m+n=![]() ;
; ,结合电子转移关系,得到4Ce3+~2HSO3~2S2O32~4Ce4+,NO~NO2~e,NO~NO3~e,根据电子守恒,得到m+3n=n(Ce4+)=4n(S2O32),可以得到②m+3n=4cy×1000,联立①②解得m=
,结合电子转移关系,得到4Ce3+~2HSO3~2S2O32~4Ce4+,NO~NO2~e,NO~NO3~e,根据电子守恒,得到m+3n=n(Ce4+)=4n(S2O32),可以得到②m+3n=4cy×1000,联立①②解得m=![]() 2000cy,根据反应2NH3+2H++O2+2NO2=2NH4NO3,得到n(O2)=
2000cy,根据反应2NH3+2H++O2+2NO2=2NH4NO3,得到n(O2)=![]() n(NO2)=(
n(NO2)=(![]() 1000cy)mol,氧气的体积V=22.4(
1000cy)mol,氧气的体积V=22.4(![]() 1000cy)×103m3=(0.21x22.4cy)m3,故答案为:0.21x22.4cy。
1000cy)×103m3=(0.21x22.4cy)m3,故答案为:0.21x22.4cy。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)现有反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,写出该反应的热化学方程式_____________________________;
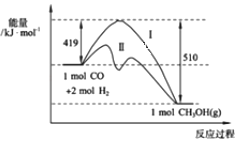
(2)已知该反应中相关的化学键键能数据如图所示,则C≡O中的键能为_____kJmol﹣1;图中曲线Ⅱ表示____________(填反应条件)的能量变化。
化学键 | H﹣H | C﹣O | H﹣O | C﹣H |
E/(kJmol﹣1) | 436 | 343 | 465 | 413 |
(3)图中数字“419”表示的是_________________________;
(4)下列反应中,属于放热反应的是_______ (填编号,下同),属于吸热反应的是_______;
①物质燃烧;②炸药爆炸;③酸碱中和反应;④二氧化碳通过炽热的碳;⑤食物因氧化而腐败;⑥Ba(OH)28H2O与NH4Cl反应;⑦铁粉与稀盐酸反应。