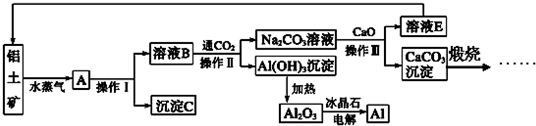
题目内容
请回答下列问题.
(1)水中存在平衡:H2O?H++OH-△H>0,欲使平衡右移,且溶液显酸性,可选的方法是
a.向水中加入NaHSO4固体 b.向水中加Na2CO3固体
c.加热至100℃d.向水中加入 (NH4)2SO4固体
(2)A、B、C、D 4种易溶于水的强电解质在水中可电离产生下列离子(各种离子不重复).
①不进行任何实验即可判断,该4种化合中有2种是
②为确定A、B、C、D的成分,某探究性学习小组进行下列实验,请完成实验结论:
(1)水中存在平衡:H2O?H++OH-△H>0,欲使平衡右移,且溶液显酸性,可选的方法是
d
d
.(选填序号)a.向水中加入NaHSO4固体 b.向水中加Na2CO3固体
c.加热至100℃d.向水中加入 (NH4)2SO4固体
(2)A、B、C、D 4种易溶于水的强电解质在水中可电离产生下列离子(各种离子不重复).
| 阳离子 | Ba2+、H+、Na+、Mg2+ |
| 阴离子 | Cl-、SO42-、CO32-、OH- |
Na2CO3
Na2CO3
、Ba(OH)2
Ba(OH)2
(填化学式),该2种化合物的溶液混合时反应的离子方程式为Ba2++CO32-=BaCO3↓
Ba2++CO32-=BaCO3↓
.②为确定A、B、C、D的成分,某探究性学习小组进行下列实验,请完成实验结论:
| 实验序号 | 实验内容 | 实验结论 |
| 1 | 用pH试纸测得A、C两溶液呈碱性,B、D两溶液呈酸性 | |
| 2 | A溶液与B溶液混合时,有无色气泡产生 | 化合物A为 Na2CO3 Na2CO3 (填化学式)B溶液中肯定大量含有H+ H+ (填离子符号); |
| 3 | C与D两溶液混合时,有白色沉淀生成,过滤,向沉淀中滴加过量盐酸,沉淀部分溶解 | 化合物B为 HCl HCl ,化合物D为MgSO4 MgSO4 (填化学式). |
分析:(1)水中存在平衡:H2O?H++OH-△H>0,欲使平衡右移,且溶液显酸性,说明是阳离子水解结合氢氧根离子生成弱电解质,溶液呈酸性;
(2)A、B、C、D 4种易溶于水的强电解质在水中可电离产生下列离子,依据离子共存分析判断,阴离子中碳酸根离子只能和钠离子组成物质碳酸钠;氢氧根离子只能和钡离子组成物质氢氧化钡;
(3)用pH试纸测得A、C两溶液呈碱性,所以为Na2CO3和Ba(OH)2 ;B、D两溶液呈酸性为MgCl2、H2SO4或MgSO4、HCl;
A溶液与B溶液混合时,有无色气泡产生,证明A为Na2CO3;B为酸含有H+;C为Ba(OH)2 ;
C与D两溶液混合时,有白色沉淀生成,过滤,向沉淀中滴加过量盐酸,沉淀部分溶解,溶解的沉淀是氢氧化镁沉淀,不溶解的是硫酸钡,判断D中为MgSO4;B为HCl;
(2)A、B、C、D 4种易溶于水的强电解质在水中可电离产生下列离子,依据离子共存分析判断,阴离子中碳酸根离子只能和钠离子组成物质碳酸钠;氢氧根离子只能和钡离子组成物质氢氧化钡;
(3)用pH试纸测得A、C两溶液呈碱性,所以为Na2CO3和Ba(OH)2 ;B、D两溶液呈酸性为MgCl2、H2SO4或MgSO4、HCl;
A溶液与B溶液混合时,有无色气泡产生,证明A为Na2CO3;B为酸含有H+;C为Ba(OH)2 ;
C与D两溶液混合时,有白色沉淀生成,过滤,向沉淀中滴加过量盐酸,沉淀部分溶解,溶解的沉淀是氢氧化镁沉淀,不溶解的是硫酸钡,判断D中为MgSO4;B为HCl;
解答:解:(1)水中存在平衡:H2O?H++OH-△H>0,欲使平衡右移,且溶液显酸性,说明是阳离子水解结合氢氧根离子生成弱电解质,溶液呈酸性;
a、向水中加入NaHSO4固体,抑制水的电离,平衡逆向进行,故a不符合;
b.向水中加Na2CO3固体,碳酸根离子水解促进水的电离,溶液呈碱性,故b不符合;
c.加热至100℃,促进水的电离,溶液是中性,故c不符合;
d.向水中加入 (NH4)2SO4固体,铵根离子水解促进水的电离,溶液呈酸性,故d符合;
故选d.
(2)①A、B、C、D 4种易溶于水的强电解质在水中可电离产生下列离子,依据离子共存分析判断,阴离子中碳酸根离子只能和钠离子组成物质碳酸钠;氢氧根离子只能和钡离子组成物质氢氧化钡;该2种化合物的溶液混合时反应的离子方程式:Ba2++CO32-=BaCO3↓,故答案为:Na2CO3;Ba(OH)2 ;Ba2++CO32-=BaCO3↓
②用pH试纸测得A、C两溶液呈碱性,所以为Na2CO3和Ba(OH)2 ;B、D两溶液呈酸性为MgCl2、H2SO4或MgSO4、HCl;
A溶液与B溶液混合时,有无色气泡产生,证明A为Na2CO3;B为酸含有H+;C为Ba(OH)2 ;
C与D两溶液混合时,有白色沉淀生成,过滤,向沉淀中滴加过量盐酸,沉淀部分溶解,溶解的沉淀是氢氧化镁沉淀,不溶解的是硫酸钡,判断D中为MgSO4;B为HCl;
故答案为:Na2CO3 ;H+;HCl;MgSO4;
a、向水中加入NaHSO4固体,抑制水的电离,平衡逆向进行,故a不符合;
b.向水中加Na2CO3固体,碳酸根离子水解促进水的电离,溶液呈碱性,故b不符合;
c.加热至100℃,促进水的电离,溶液是中性,故c不符合;
d.向水中加入 (NH4)2SO4固体,铵根离子水解促进水的电离,溶液呈酸性,故d符合;
故选d.
(2)①A、B、C、D 4种易溶于水的强电解质在水中可电离产生下列离子,依据离子共存分析判断,阴离子中碳酸根离子只能和钠离子组成物质碳酸钠;氢氧根离子只能和钡离子组成物质氢氧化钡;该2种化合物的溶液混合时反应的离子方程式:Ba2++CO32-=BaCO3↓,故答案为:Na2CO3;Ba(OH)2 ;Ba2++CO32-=BaCO3↓
②用pH试纸测得A、C两溶液呈碱性,所以为Na2CO3和Ba(OH)2 ;B、D两溶液呈酸性为MgCl2、H2SO4或MgSO4、HCl;
A溶液与B溶液混合时,有无色气泡产生,证明A为Na2CO3;B为酸含有H+;C为Ba(OH)2 ;
C与D两溶液混合时,有白色沉淀生成,过滤,向沉淀中滴加过量盐酸,沉淀部分溶解,溶解的沉淀是氢氧化镁沉淀,不溶解的是硫酸钡,判断D中为MgSO4;B为HCl;
故答案为:Na2CO3 ;H+;HCl;MgSO4;
点评:本题考查了水的电离平衡的影响因素的分析判断,物质检验的方法,离子共存的应用,综合性较强,需要熟练掌握物质的性质,反应现象是解题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
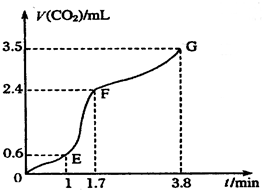 Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题: