题目内容
9.6克A原子与4.2克B原子含有相同的原子数,A、B原子核中各自的质子数和中子数相等,已知A元素在其最高价氧化物中的质量分数为40%,在其氢化物中的质量分数为94.1%,试通过计算确定:
(1)A、B的元素符号及在元素周期表中的位置;
(2) A、B的相对原子质量。
(1)A、B的元素符号及在元素周期表中的位置;
(2) A、B的相对原子质量。
(1)A:S,第三周期第Ⅵ族;B:N,第二周期,第Ⅴ族
(2)A:32;B:14
(2)A:32;B:14
试题分析::推出A的氢化物分子式为HxA,最高价氧化物分子式应该是A2O8-x,通过题给的条件求出A的相对原子质量:A/(x+A)=94.1%,A/(A+16*(8-x)/2)=40%,可解得x=2,A=32。再利用题目中A、B质量关系和原子数关系求出B的原子量:由于9.6g元素A与4.2g元素B含有相同的原子数,设B的原子量为y,由9.6/32="4.2/y,y=14" 。最后根据两种元素原子的质子数确定在周期表中的位置。
点评:本题考查质量分数的计算,依据题意求出相对原子质量,并判断元素在周期表中的位置,综合性较强,题目难度较大。

练习册系列答案
相关题目
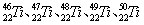 等。这些同位素原子的中子数不可能为
等。这些同位素原子的中子数不可能为 和
和
