题目内容
“酒是陈的香”,就是因为酒在储存过程中生成了有香味乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题:
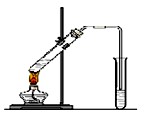
(1)写出制取乙酸乙酯的化学反应方程式 。
(2)饱和碳酸钠溶液的主要作用是中① ② ;③
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液,
目的是防止 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应未达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化

(1)写出制取乙酸乙酯的化学反应方程式 。
(2)饱和碳酸钠溶液的主要作用是中① ② ;③
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液,
目的是防止 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应未达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(1)

(2) ① 减少乙酸乙酯的溶解度 ② 除去乙酸 ;③ 除去乙醇
(3) 倒吸
(4)分液
(5) ①③

(2) ① 减少乙酸乙酯的溶解度 ② 除去乙酸 ;③ 除去乙醇
(3) 倒吸
(4)分液
(5) ①③
试题分析:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,其反应方程式为
 ;(2)饱和碳酸钠溶液的主要作用是减少乙酸乙酯的溶解度 、除去乙酸 、 除去乙醇;(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,因为蒸汽含有乙醇乙酸,所以不能插入溶液,目的是防止倒吸;(4)乙酸乙酯不溶于饱和碳酸钠溶液,所以可以用分液的方法将其分离;(5)根据
;(2)饱和碳酸钠溶液的主要作用是减少乙酸乙酯的溶解度 、除去乙酸 、 除去乙醇;(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,因为蒸汽含有乙醇乙酸,所以不能插入溶液,目的是防止倒吸;(4)乙酸乙酯不溶于饱和碳酸钠溶液,所以可以用分液的方法将其分离;(5)根据 可以知道,单位时间里,生成1mol乙酸乙酯,同时生成1mol水或者是单位时间里消耗1mol乙醇,同时消耗1mol乙酸,不能说明反应已经达到平衡,其他都可以说明反应达到平衡,故本题的答案选择①③。
可以知道,单位时间里,生成1mol乙酸乙酯,同时生成1mol水或者是单位时间里消耗1mol乙醇,同时消耗1mol乙酸,不能说明反应已经达到平衡,其他都可以说明反应达到平衡,故本题的答案选择①③。点评:该题考查了酯化反应,乙酸乙醇的酯化反应是中心的经典反应,是高考考查的重点,本题属于对基础知识的考查,难度不大。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
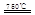 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg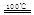 HgBr2+H2
HgBr2+H2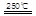 _____ + ④2HgO
_____ + ④2HgO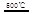 2Hg+O2↑
2Hg+O2↑ CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
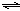 W(g) + Z(g),下列物理量不能用于表明反应是否已达到平衡状态的是
W(g) + Z(g),下列物理量不能用于表明反应是否已达到平衡状态的是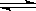 2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。 2Z(g)达到限度的标志是( )
2Z(g)达到限度的标志是( ) pC(g)+qD(g)。若增大压强或升高温度,重新达到平衡,随时间变化过程均如图所示,则对该反应的叙述中正确的是( )
pC(g)+qD(g)。若增大压强或升高温度,重新达到平衡,随时间变化过程均如图所示,则对该反应的叙述中正确的是( )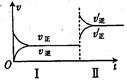
 H2S(g) K1,
H2S(g) K1, SO2(g) K2。则相同温度下反应H2(g)+SO2(g)
SO2(g) K2。则相同温度下反应H2(g)+SO2(g) 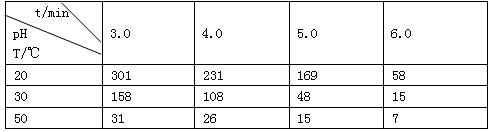
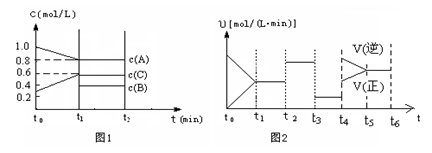
 CH3OH(g)反应合成甲醇。
CH3OH(g)反应合成甲醇。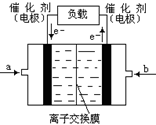
 2NH3而言,无论怎样控制反应条件1mol N2与3mol H2反应都不会生成2mol NH3
2NH3而言,无论怎样控制反应条件1mol N2与3mol H2反应都不会生成2mol NH3