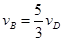��Ŀ����
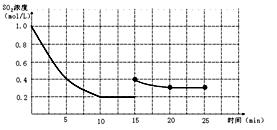
��9�֣���֪��2SO2(g)+O2(g) 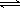 2SO3(g)����H=��196 kJ/mo1��850Kʱ����2L�̶��ݻ����ܱ������г���2mol SO2��2mol O2��10���Ӻ�ﵽƽ�⣬SO2Ũ�Ⱥ�ʱ���ϵ��ͼ��
2SO3(g)����H=��196 kJ/mo1��850Kʱ����2L�̶��ݻ����ܱ������г���2mol SO2��2mol O2��10���Ӻ�ﵽƽ�⣬SO2Ũ�Ⱥ�ʱ���ϵ��ͼ��
�ش���������
��1��ǰ10������O2��ƽ����Ӧ����Ϊ mol/(L��min)
��2��ƽ��ʱ��02��ת����Ϊ ����ʱ��Ӧ������ kJ��
��3����15����ʱά���¶Ȳ��䣬ѹ�����������ʹ�������Ϊ1L��������20����ʱ�ﵽ��ƽ�⣬��ʱc��O2��=1��15 mol/L������ͼ�ϻ���15-25����SO2��Ũ�ȱ仯���ߡ�
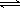 2SO3(g)����H=��196 kJ/mo1��850Kʱ����2L�̶��ݻ����ܱ������г���2mol SO2��2mol O2��10���Ӻ�ﵽƽ�⣬SO2Ũ�Ⱥ�ʱ���ϵ��ͼ��
2SO3(g)����H=��196 kJ/mo1��850Kʱ����2L�̶��ݻ����ܱ������г���2mol SO2��2mol O2��10���Ӻ�ﵽƽ�⣬SO2Ũ�Ⱥ�ʱ���ϵ��ͼ��
�ش���������
��1��ǰ10������O2��ƽ����Ӧ����Ϊ mol/(L��min)
��2��ƽ��ʱ��02��ת����Ϊ ����ʱ��Ӧ������ kJ��
��3����15����ʱά���¶Ȳ��䣬ѹ�����������ʹ�������Ϊ1L��������20����ʱ�ﵽ��ƽ�⣬��ʱc��O2��=1��15 mol/L������ͼ�ϻ���15-25����SO2��Ũ�ȱ仯���ߡ�
��1��0��04��2�֣�
��2��40% (2��) 156��8 (2��)
��3��(3��)
��2��40% (2��) 156��8 (2��)
��3��(3��)

�����������1��ǰ10������O2��ƽ����Ӧ����=1/2V(SO2)=1/2(1-0��2)/10=0��04mol/(L��min)����2�� һ���¶��£���0��4molSO2��0��2molO2����̶��ݻ�Ϊ2L���ܱ������У�������Ӧ2SO2��g��+O2��g��?2SO3��g����H=-196��6kJ/mol����Ӧ��SO3�����ʵ���Ũ�ȵı仯�����ͼ�����õ�ƽ��ʱC��SO3��=0��1mol/L��ƽ�����������������ʵ���=0��1mol/L��2L=0��2mol�����ݻ�ѧƽ������ʽ��ʽ����
2SO2��g��+O2��g��?2SO3��g����H=-196��6kJ/mol��
��ʼ����mol/L�� 1 1 0
�仯����mol/L�� 08 0��4 0��8
ƽ������mol/L�� 0��2 0��6 0��8
��������ת����=0��4/1=40%��Q=0��8*196��6=156��8kJ��
��2���ڵ�15����ĩ�������������Сһ���ʱ�����ʵ���Ũ������һ����ѹǿ����ƽ��������У���20����ʱ�ﵽ��ƽ�⣬��ʱc��O2��=1��15 mol/L��
2SO2��g��+O2��g��?2SO3��g����H=-196��6kJ/mol��
��ʼ����mol/L�� 0��4 1��2 1��6
�仯����mol/L�� 0��1 0��05 0��1
ƽ������mol/L�� 0��3 1��15 1��7
�յ���������Ũ��Ϊ0��3 mol/L�����߱仯�������£�20����֮��Ũ�Ȳ��䡣��ͼ�����£�


��ϰ��ϵ�д�
 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�
�����Ŀ
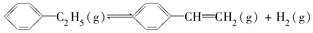 ����H��a kJ��mol��1����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
����H��a kJ��mol��1����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±��� (W)��3
(W)��3 2Z(g)+2W(g)��2L�ܱ������н��У�5min��Y������0.5mol����˷�Ӧ������vΪ( )
2Z(g)+2W(g)��2L�ܱ������н��У�5min��Y������0.5mol����˷�Ӧ������vΪ( ) ����x����ij��Ӧ���������)֮��Ĺ�ϵ����ȷ���ǣ��� ��
����x����ij��Ӧ���������)֮��Ĺ�ϵ����ȷ���ǣ��� �� 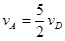
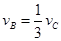 ��
��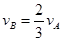 ��
��