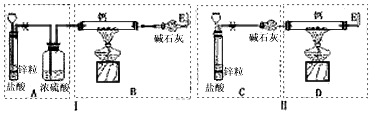
题目内容
已知:碱金属或碱土金属(ⅡA)与H2在隔绝空气加热时可以发生反应,生成离子型金属氢化物,如NaH、CaH2等,它们易与水反应。现有甲、乙两位同学分别设计了制备纯净CaH2的实验,装置如图所示(分别以序号I、II表示),铁架台等夹持固定仪器已略去(H2的稳定性强于HCl)。
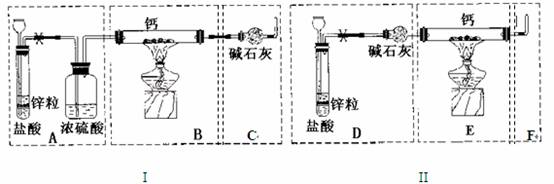
请回答下列问题
(1)锌与盐酸反应的离子方程式为 ;
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷。
装置I的不足之处是 ,
装置II的不足之处是 ;
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C……表示) ;
(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先 ,然后再 ,才能点燃酒精灯加热。
(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为 ,该反应中的氧化剂是_______。
(1)Zn+2H+=Zn2++H2↑
(2)缺少除去HCl的装置; 缺少防止空气中水蒸汽进入的装置
(3) D B (E) C(其它合理答案也可)
(4)通氢气; 验纯
(5) CaH2+2H2O=Ca(OH)2+H2↑; H2O;

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案
相关题目