题目内容
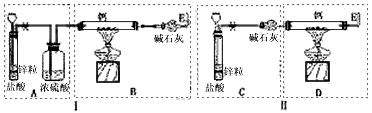
已知:碱金属或碱土金属(Ⅱ族)与H2在隔绝空气加热时要以发生反应,生成离子型金属氢化物,如NaH、CaH2等,它们易与水反应.现有甲、乙两位同学分别设计了制备CaH2的实验,装置如图所示(分别以序号Ⅰ、Ⅱ表示),铁架台等夹持固定仪器已略去.

请回答下列问题
(1)锌与盐酸反应的离子方程式为
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷.
装置Ⅰ的不足之处是
装置Ⅱ的不足之处是
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C…表示)
(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先
(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为

请回答下列问题
(1)锌与盐酸反应的离子方程式为
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
;(2)最后实验结果显示,两位同学的实验装置设计都有缺陷.
装置Ⅰ的不足之处是
制H2装置后缺少除HCl气体的装置
制H2装置后缺少除HCl气体的装置
,装置Ⅱ的不足之处是
制CaH2装置后缺少干燥装置
制CaH2装置后缺少干燥装置
;(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C…表示)
C、B
C、B
;(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先
通氢气
通氢气
,然后再检验氢气纯度至达标
检验氢气纯度至达标
,才能点燃酒精灯加热.同样,为了安全,反应开始后,在E口处应点燃尾气(或外接气体等)
点燃尾气(或外接气体等)
;(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为
CaH2+2H2O=Ca(OH)2+2H2↑
CaH2+2H2O=Ca(OH)2+2H2↑
.分析:由于盐酸易挥发,锌与盐酸反应制得气体氢气中混有氯化氢和水蒸气,需先除去.因碱金属或碱土金属(Ⅱ族)与H2在隔绝空气加热时发生反应,所以需把装置中的空气排净.CaH2与水反应产生H2,故需要干燥环境.
解答:解:(1)锌与盐酸反应的化学方程式为Zn+2HCl=ZnCl2+H2↑,故答案为:Zn+2H+=Zn2++H2↑;
(2)锌与盐酸反应制得气体氢气中混有氯化氢和水蒸气,会与锌反应.浓硫酸只除去水蒸气,故应增加除氯化氢装置.故装置Ⅰ的不足之处是制H2装置后缺少除HCl气体的装置;CaH2易与水反应,为防空气中水与CaH2反应,应在制CaH2装置后加干燥装置. 故装置Ⅱ的不足之处是制CaH2装置后缺少干燥装置.
故答案为:制H2装置后缺少除HCl气体的装置;制CaH2装置后缺少干燥装置;
(3)C中碱石灰会把氢气中的杂质氯化氢和水吸收,B中碱石灰可防止空气中水蒸气与CaH2反应,故答案为:C、B;
(4)氢气具有可燃性,为防爆炸,故加热前应先检查氢气的纯度,尾气处理可采取燃烧的方法.
故答案为:通氢气;检验氢气纯度至达标 点燃尾气(或外接气体等);
(5)根据题给信息,反应物为CaH2和水,产物为氢气和氢氧化钙,由此可写出化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,
故答案为:CaH2+2H2O=Ca(OH)2+2H2↑.
(2)锌与盐酸反应制得气体氢气中混有氯化氢和水蒸气,会与锌反应.浓硫酸只除去水蒸气,故应增加除氯化氢装置.故装置Ⅰ的不足之处是制H2装置后缺少除HCl气体的装置;CaH2易与水反应,为防空气中水与CaH2反应,应在制CaH2装置后加干燥装置. 故装置Ⅱ的不足之处是制CaH2装置后缺少干燥装置.
故答案为:制H2装置后缺少除HCl气体的装置;制CaH2装置后缺少干燥装置;
(3)C中碱石灰会把氢气中的杂质氯化氢和水吸收,B中碱石灰可防止空气中水蒸气与CaH2反应,故答案为:C、B;
(4)氢气具有可燃性,为防爆炸,故加热前应先检查氢气的纯度,尾气处理可采取燃烧的方法.
故答案为:通氢气;检验氢气纯度至达标 点燃尾气(或外接气体等);
(5)根据题给信息,反应物为CaH2和水,产物为氢气和氢氧化钙,由此可写出化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,
故答案为:CaH2+2H2O=Ca(OH)2+2H2↑.
点评:进行实验评价时,可从实验目的、装置特点、题给信息及试剂性质综合考虑.

练习册系列答案
相关题目