题目内容
【题目】海水中含有丰富的化工原料资源,可以从海水中提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:试回答下列问题: 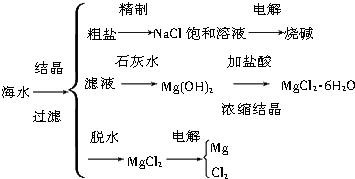
(1)粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,除去Mg2+所用试剂为 .
A.过量盐酸
B.过量BaCl2溶液
C.过量NaOH溶液
D.过量Na2CO3溶液
(2)电解饱和食盐水时,阴极反应为 . 若欲将电解后饱和食盐水恢复至电解前,则可采取的方法是
(3)由MgCl26H2O晶体脱水制无水MgCl2时,MgCl26H2O晶体应在通入气体的气氛中加热脱水,该气体的作用是 .
(4)电解无水MgCl2所得的镁蒸气可以在下列气体中冷却.
A.Ar
B.N2
C.CO2
D.O2 .
【答案】
(1)C
(2)2H2O+2e﹣═H2+2OH﹣;通入一定量的HCl气体
(3)HCl;抑制水解平衡MgCl2+H2O?Mg(OH)Cl+HCl正向进行
(4)A
【解析】解:(1)因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,除去Mg2+所用试剂为C,
所以答案是:C;
(2.)电解饱和食盐水时,与正极相连的阳极发生的反应是2Cl﹣﹣2e→Cl2 , 与负极相连的阴极发生的反应是:2H++2e→H2 . H+不断消耗,使得溶液中[OH﹣]增大,电解中外溢的是Cl2、H2 , 所以要确保原溶液浓度不变,只能向体系中通入一定量的HCl气体以补足损失的H、Cl原子;
所以答案是:2H2O+2e﹣═H2+2OH﹣;通入一定量的HCl气体;
(3.)直接加热MgCl23H2O晶体得不到无水MgCl2的原因是,加热生成的水中氯化镁水解生成氢氧化镁,得不到氯化镁,MgCl26H2O晶体在HCL气流中加热脱水,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2 , 6H2O受热产生的水汽,故能得到无水MgCl2;该气体的作用是抑制水解平衡MgCl2+H2OMg(OH)Cl+HCl正向进行;
所以答案是:HCl;抑制水解平衡MgCl2+H2OMg(OH)Cl+HCl正向进行;
(4.)能和金属镁发生反应的气体:氮气、氧气、二氧化碳,所以可以用氢气做镁蒸气的冷却剂,所以答案是:A.