题目内容
【化学——选修2:化学与技术】(15分)
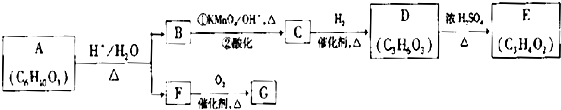
KMnO4是一种常用的强氧化剂,工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产。即在反应器中碱性条件下用氧气氧化KnO2得到K2MnO4,分离后得到K2MnO4,再在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
回答下列问题:
(1)写出反应器中反应的方程式_______
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量较低的贫矿中Al的氧化物含量较高,会导致KOH消耗量偏离,用离子方程式表示KOH消耗偏高的原因____。
(3)写出电解槽中阴极和阳极的电极反应方程式阴极:_______ :阳极:____。
(4)在传统工艺中,得到K2MnO4后,向其溶液中避入CO2制备KMnO4,配平方程式:
K2MnO4+_______CO2=" _______KMnO4+_______ " MnO2+ _______K2CO3
将所得到的KMnO4配成0.1mol·L-1KMnO4溶液,滴定20.00 rnL未知浓度的FeCl2液,消耗KMnO4溶液30.00 mL。滴定达到终点时的现象为:_______ ,则FeCl2溶液的浓度为_______mol/L。
[化学——选修2:化学与技术](15分)
⑴4KOH+2MnO2+O2=2K2MnO4+2H2O(2分)
⑵2OH-+Al2O3=2AlO2-+H2O(2分)
⑶阴极:2H2O+2e-=H2↑+2OH-(2分)(写成2H++2e-=H2↑也给分)
阳极:2MnO42--2e-=2MnO4-(2分)
⑷3、2、2、1、2(2分);溶液从浅绿色变为紫红色并且在30秒内不褪色(2分);
0.75mol·L-1(3分)
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【化学--选修:物质结构与性质】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式: .
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 .
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为 .
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为 ,其中心离子是 ,配位数为 .
(5)根据下列四种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
①在周期表中,最可能处于同一族的是 和 .
②T元素最可能是 区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为 ,其中心原子的杂化方式为 .
(1)写出制备 NF3的化学反应方程式:
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为
(5)根据下列四种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是
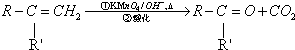 (R、R′可表示烃基或官能团)
(R、R′可表示烃基或官能团)