题目内容
【题目】下表是元素周期表的一部分,表中的①~⑩是相应元素的代码,请用数字所对应元素的化学用语回答下列问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素是___(填元素符号,下同),形成化合物种类最多的元素是________ 。
(2)第三周期元素中除⑩以外原子半径最大的是_____(填元素符号);这些元素的最高价氧化物对应水化物中:酸性最强的物质是___(填化学式,下同),具有两性的物质是____。
(3)⑧⑨两种元素非金属性的强弱顺序为__>__(填元素符号),得出该判断的实验依据是___(写出一种即可)。
(4)用电子式表示④与⑥形成化合物的过程:_______。
【答案】Ar C Na HClO4 Al(OH)3 Cl S Cl2较S更易与H2化合;②HCl较H2S稳定;③HClO4的酸性较H2SO4强;④Cl2可以与S2-反应将S置换出来(写出一种即可) ![]()
【解析】
首先根据元素在周期表的相对位置判断各种元素,然后利用元素的位、构、性三者的关系进行逐一解答。
根据元素在周期表的相对位置可知从①至⑩号元素分别是C、N、O、F、Na、Mg、Al、S、Cl、Ar。
(1)在这些元素中,化学性质最不活泼的元素是惰性气体元素Ar;形成化合物种类最多的元素是C元素。
(2)对于同一周期的元素,原子序数越大,原子半径越小,所以第三周期元素中除⑩以外原子半径最大的是Na;同一周期的元素,随原子序数的增大,元素的非金属性逐渐增强,元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,所以这些元素的最高价氧化物对应水化物中:酸性最强的物质是HClO4,具有两性的物质是Al(OH)3。
(3)同一周期的元素,随原子序数的增大,元素的非金属性逐渐增强,所以⑧、⑨两种元素非金属性的强弱顺序为Cl>S,元素的非金属性越强,其单质与氢气化合越容易;元素的非金属性越强其相应的氢化物的稳定性越强;元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,得出该判断的实验依据是与氢气化合难易程度Cl2>S;氢化物的稳定性HCl>H2S;酸性:HClO4>H2SO4等。
(4)④与⑥形成化合物MgF2是离子化合物,Mg2+与F-离子之间通过离子键结合,用电子式表示形成该化合物的过程:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:
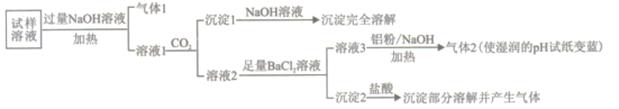
已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。