题目内容
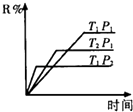
【题目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-、Br-中的几种。①若加入铝粉,产生的气体是H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则:

(1)溶液中的阳离子一定含有__________,阴离子无法确定是否存在的是___________。
(2)O→A、C→D的离子方程式为:
O→A____________________________________。
C→D______________________________________。
(3)为确定上述阴离子是否含有,只需向原溶液中加入某试剂,并测定产生的沉淀质量即可。下列试剂符合要求的是_______。
A.AlCl3 B.NaOH C.Ba(OH)2 D.BaCl2
若加入足量上述所选试剂后,产生沉淀质量为46.6克,则上述溶液中所有的阴离子及其物质的量为:____________、_______________(没有就不填)。
【答案】 H+、NH4+、Mg2+、Al3+ SO42-、Br- H++OH-=H2O Al(OH)3+OH-=AlO2-+2H2O D SO42- 0.2mol Br- 0.3mol
【解析】①若加入铝粉,产生的气体是H2,因此必须含有氢离子,则一定不存在CO32-、NO3-;②若加入NaOH溶液,产生白色沉淀,说明不存在Fe3+。根据图像可知沉淀达到最大值以后沉淀开始减少,但不完全消失,所以一定存在Mg2+、Al3+;BC阶段沉淀不变化,说明还含有铵根离子,SO42-、Br-无法确定,根据溶液显电中性可知二者至少含有一种。
(1)根据以上分析可知溶液中的阳离子一定含有H+、NH4+、Mg2+、Al3+,阴离子无法确定是否存在的是SO42-、Br-。(2)O→A是中和氢离子,方程式为H++OH-=H2O;C→D是溶解氢氧化铝,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。(3)A.AlCl3与硫酸根和溴离子均不反应,A错误;B.NaOH与硫酸根和溴离子均不反应,B错误;C.Ba(OH)2与硫酸根反应生成硫酸钡沉淀,但同时产生氢氧化镁沉淀,C错误;D.BaCl2只与硫酸根反应生成硫酸钡沉淀,D正确;46.6g沉淀是硫酸钡,物质的量是46.6g÷233g/mol=0.2mol,所以硫酸根的物质的量是0.2mol;根据图像可知与氢离子反应的氢氧化钠是0.1mol,则氢离子是0.1mol;与铵根反应的氢氧化钠是0.7mol-0.5mol=0.2mol,因此铵根是0.2mol,溶解氢氧化铝消耗氢氧化钠是0.8mol-0.7mol=0.1mol,则铝离子是0.1mol,产生0.1mol氢氧化铝消耗氢氧化钠是0.3mol,因此与镁离子反应的氢氧化钠是0.5mol-0.1mol-0.3mol=0.1mol,因此镁离子是0.05mol,根据电荷守恒可知一定含有溴离子,物质的量是0.1mol+0.2mol+0.1mol×3+0.05mol×2-0.2mol×2=0.3mol。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________
该反应中氧化剂是_____;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________。
【题目】800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
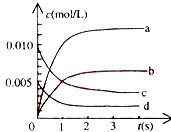
①图中表示NO2变化的曲线是 , 用O2表示从0~2s内该反应的平均速率v= .
②能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.